Dấu hiệu của các rối loạn tương bào là sự sản xuất các phân tử hoặc mảnh vỡ globulin miễn dịch từ các tương bào bất thường. Phân tử globulin miễn dịch nguyên vẹn hoặc chuỗi nặng hay nhẹ sản xuất bởi dòng tương bào bất thường được tìm thấy trong huyết thanh và/hoặc nước tiểu và được gọi là M component (đối với đơn dòng). Số lượng M component trong bất kỳ bệnh nhân nào phản ánh thể tích khối u của bệnh nhân đó. Trong một số trường hợp sự hiện diện của dòng chuỗi nhẹ (Bence Jones protein) là sản phẩm duy nhất của khối u được phát hiện. M component có thể thấy ở các bệnh nhân u lympho khác, ung thư không phải lympho và các tình trạng không phải lympho như xơ gan, sarcoidosis, nhiễm ký sinh trùng và các bệnh tự miễn.
ĐA U TỦY XƯƠNG
Là sự tăng sinh ác tính của tương bào trong tủy xương (đặc biệt không ở hạch lympho). Gần 22,000 ca mới mắc được chẩn đoán mỗi năm. Biểu hiện của bệnh là hậu quả của việc mở rộng khối u, các hoạt động tại chỗ và ở xa của các sản phẩm khối u và đáp ứng của vật chủ với khối u. Khoảng 70% bệnh nhân có đau xương thường đau lưng và các xương sườn, đau tăng khi cử động. Tổn thương xương nhiều, tiêu xương và hiếm khi kèm theo phản ứng tạo xương. Vì vậy, quét xương ít giá trị hơn chụp X quang. Các tế bào u sản xuất các cytokine hoạt hóa tế bào hủy xương dẫn đến huy động canxi đáng kể, tăng canxi máu và các triệu chứng liên quan. Giảm tổng hợp và tăng dị hóa của globulin miễn dịch bình thường dẫn đến giảm gammaglobulin máu và sản phẩm khối u kém xác định ức chế sự di cư bạch cầu hạt. Những thay đổi này tạo ra sự nhạy cảm với nhiễm vi khuẩn, đặc biệt là phế cầu, Klebsiella pneumoniae và Staphylococcus aureus ảnh hưởng đến phổi và Escherichia coli và các vi khuẩn gram âm khác ảnh hưởng đến đường tiết niệu. Nhiễm trùng ảnh hưởng đến 75% bệnh nhân ở các thời điểm trong quá trình bệnh. Suy thận có thể gặp ở 25% bệnh nhân; cơ chế bệnh sinh do nhiều yếu tố tăng canxi máu, nhiễm trùng, độc tính của các chuỗi nhẹ, bệnh thận urat, mất nước. Các triệu chứng thần kinh là hậu quả của tăng độ nhớt máu, cryoglobulin và hiếm khi lắng đọng amyloid ở các dây thần kinh. Thiếu máu xảy ra ở 80% liên quan đến sự hủy hoại tủy và ức chế tạo hồng cầu do các sản phẩm u. Các bất thường đông máu có thể gây chảy máu.
Chẩn Đoán
Tế bào tương bào tủy >10%, tổn thương tiêu xương và M component trong máu và/hoặc nước tiểu là tam chứng cổ điển. Bệnh lý gamma đơn dòng có ý nghĩa không xác định (MGUS) phổ biến hơn nhiều so với u tủy, ảnh hưởng đến khoảng 6% người trên 70 tuổi; nhìn chung, MGUS đi kèm với nồng độ M component <20 g/L, β2-microglobulin huyết thanh thấp, <10% tế bào tương bào tủy và không có tổn thương xương. Nguy cơ MGUS tiến triển thành u tủy trong cả cuộc đời là khoảng 25%.
Giai đoạn
Giai đoạn bệnh ảnh hưởng thời gian sống thêm (Bảng 73-4).
Khoảng 10% bệnh nhân có bệnh tiến triển rất chậm và không cần điều trị cho đến khi nồng độ paraprotein tăng trên 50 g/L hoặc xuất hiện bệnh lý xương tiến triển. Bệnh nhân có u tương bào đơn độc và u tương bào ngoài tủy thường được chữa khỏi bằng xạ trị khu trú. Chăm sóc hỗ trợ bao gồm điều trị nhiễm trùng sớm; kiểm soát tăng canxi máu bằng glucocorticoid, hydrat hóa và natri niệu; tiêm bisphosphonates kéo dài để đối kháng hủy xương; và dự phòng bệnh thận urat và mất nước. Điều trị nhằm vào các khối u thường là giảm nhẹ. Điều trị ban đầu thường là một trong nhiều phương pháp dựa trên liệu bệnh nhân có thể áp dụng điều trị liều cao hoặc ghép tế bào gốc tự thân không. Đủ điều kiện cấy ghép (tránh tác nhân alkyl hóa): thalidomide, 400 mg/d uống hoặc 200 mg mỗi tối trước khi ngủ, thêm dexamethasone, 40 mg/d vào ngày 14 mỗi tháng, kèm theo hoặc không bortezomib hoặc hóa chất như doxorubicin dạng mỡ. Không thích hợp cấy ghép: melphalan, 8 mg/m2 uống trong 47 ngày mỗi 46 tuần, thêm prednisone. Khoảng 60% bệnh nhân có cải thiện triệu chứng đáng kể kèm theo giảm 75% M component. Bortezomib làm tăng tỷ lệ đáp ứng với melphalan. Phương pháp tiếp cận thực nghiệm sử dụng các xung liều cao của melphalan cộng với hai ca ghép tế bào gốc tự thân liên tiếp tạo ra đáp ứng hoàn toàn ở khoảng 50% bệnh nhân <65 tuổi. Theo dõi dài hạn rất cần thiết để xem liệu sự sống có được nâng lên. Điều trị giảm nhẹ thường sau thời gian điều trị liên tục khoảng 25 năm, theo sau bởi một giai đoạn tăng tốc đặc trưng bởi thâm nhiễm cơ quan với các tế bào u tủy và suy tủy. Điều trị tích cực hơn có thể kéo dài thời gian sống trung bình là 6 năm. Phương pháp mới điều trị hỗ trợ gồm bortezomib, 1.3 mg/m2 vào ngày 1, 4, 8 và 11 mỗi 3 tuần, thường dùng với dexamethasone, vincristine và/hoặc doxorubicin dạng mỡ.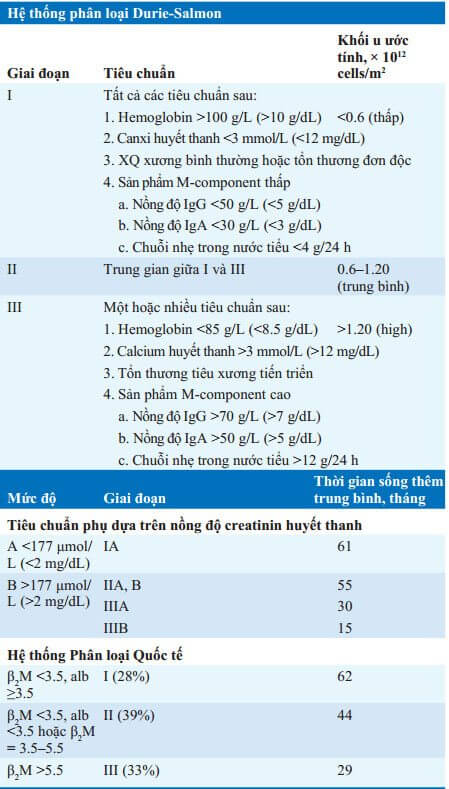
Lenalidomide cũng có hiệu quả và được dùng như điều trị duy trì.
BỆNH HODGKIN
Khoảng 9000 ca mới được chẩn đoán mỗi năm. Bệnh Hodgkin (HD) là khối u của tế bào Reed-Sternberg, các tế bào thể lệch bội thường biểu lộ CD30 và CD15 nhưng cũng có thể biểu lộ các marker tế bào B hoặc T khác. Phần lớn các tế bào có nguồn gốc từ tế bào B trong đó các gen globulin miễn dịch được sắp xếp lại nhưng không biểu hiện. Hầu hết các tế bào trong hạch to là tế bào lympho bình thường, tương bào, bạch cầu đơn nhân và bạch cầu ái toan. Sinh bệnh học chưa rõ nhưng tỷ lệ trong cặp song sinh cùng trứng là 99-tăng gấp nhiều lần so với tỷ lệ bình thường, gợi ý tính nhạy cảm di truyền. Phân bố của các phân nhóm mô học là 75% xơ nốt, 20% hỗn hợp tế bào, thể nhiều lympho bào và ít lympho bào chiếm khoảng 5%.
Đặc Điểm Lâm Sàng
Thường xuất hiện với hạch to không triệu chứng hoặc viêm hạch kèm theo sốt, ra mồ hôi đêm, gầy sút cân và đôi khi ngứa. Viêm hạch trung thất (thường trong bệnh Hodgkin thể xơ nốt) gây ra ho. Bệnh có xu hướng lan ra các nhóm hạch bạch huyết lân cận. Có thể có biểu hiện tắc tĩnh mạch chủ trên hoặc chèn ép tủy sống. Hiếm khi có tổn thương tủy xương và gan.
Chẩn Đoán Phân Biệt
Nhiễm trùngtăng bạch cầu đơn nhân, hội chứng virus, Toxoplasma, Histoplasma, lao
Các ung thư khácđặc biệt ung thư vùng đầu cổ
Bệnh Sarcoidosis viêm hạch trung thất và rốn phổi Các Bất Thường Miễn Dịch Và Huyết Học
Khiếm khuyết trong miễn dịch trung gian tế bào (còn duy trì ngay cả khi điều trị thành công u lympho); anergy da; giảm sản xuất kháng thể kháng kháng nguyên vỏ của Haemophilus và phế cầu
Thiếu máu; tốc độ máu lắng tăng; phản ứng bạch cầu; tăng bạch cầu ái toan; giảm lympho bào; xơ và u hạt ở tủy
Giai Đoạn
Bảng phân loại Ann Arbor được trình bày trong Bảng 73-5. Bệnh được phân loại dựa trên khám lâm sàng, chụp X quang, chụp CT ngực bụng, sinh thiết thủy xương; siêu âm, chụp mạch bạch huyết. Nên mở bụng để đánh giá, đặc biệt đánh giá lách, nếu bệnh ở giai đoạn sớm trên lâm sàng và đang dự định xạ trị. Phân loại bệnh học không cần thiết nếu bệnh nhân được điều trị bằng hóa trị.
BẢNG 73-5 PHÂN CHIA GIAI ĐOẠN ANN ARBOR CHO BỆNH HODGKIN
| Giai đoạn | Định nghĩa |
| I | Tổn thương giới hạn trong một vùng hạch hoặc cơ quan bạch huyết duy nhất (VD lách, tuyến ức, vòng Waldeyer) |
| II | Tổn thương từ hai vùng hạch trở lên ở cùng một phía của cơ hoành (trung thất là một vị trí; các hạch rốn phổi nên được tính riêng từng bên, khi tổn thương cả hai bên xếp vào giai đoạn II) |
| III | Tổn thương các vùng hạch hoặc cơ quan bạch huyết ở cả hai phía của cơ hoành |
| III1 | Tổn thương dưới hoành giới hạn ở lách, hạch rốn lách, các hạch tạng hoặc hạch cửa |
| III2 | Tổn thương dưới hoành gồm các hạch cạnh động mạch chủ, chậu hoặc hạch mạc treo cộng với các cơ quan III1 |
| IV | Tổn thương (các) vị trí ngoài hạch xa được chỉ định là E Hơn một lắng đọng ngoài hạch ở bất kỳ vị trí nào Bất kỳ tổn thương của gan hoặc tủy xương |
| A | Không triệu chứng |
| B | Sút cân không có nguyên nhân >10% trọng lượng cơ thể trong 6 tháng trước khi đánh giá giai đoạn Sốt >38°C không rõ nguyên nhân, kéo dài hoặc tái phát trong các tháng trước đó Vã mồ hôi đêm tái phát trong tháng trước đó |
| E | Tổn thương khu trú, đơn độc của mô ngoài bạch huyết, trừ gan và tủy xương |
Khoảng 85% bệnh nhân có thể chữa được. Điều trị nên được thực hiện bởi các bác sỹ giàu kinh nghiệm ở các trung tâm có phương tiện phù hợp. Hầu hết các bệnh nhân được phân loại lâm sàng và điều trị bằng đơn hóa trị hoặc liệu pháp đa mô thức. Những bệnh nhân có bệnh khu trú được điều trị bằng xạ trị đơn độc. Những bệnh nhân giai đoạn II thường nhận hai hoặc bốn chu kỳ ABVD cộng với xạ trị trường chiếu liên quan hoặc Stanford V, phác đồ đa mô thức sử dụng hóa chất liều thấp. Những bệnh nhân giai đoạn III hoặc IV nhận sáu chu kỳ hóa chất kết hợp, thường là ABVD. Bệnh nhân ở bất kỳ giai đoạn nào có khối u trung thất lớn (lớn hơn một phần ba đường kính lớn nhất của phổi) nên nhận liệu pháp đa mô thức với MOPP/ABVD hoặc MOPP-ABV phối hợp sau xạ trị trường chiếu ngoài. (Xạ trị với ABVD rất độc với phổi.) Chụp cắt lớp phát xạ positron giữa điều trị tích cực liên tục là chỉ số đánh giá nguy cơ tái phát và cần điều trị bổ sung. Khoảng một nửa số bệnh nhân (hoặc hơn) không khỏi sau phác đồ hóa chất ban đầu có thể được cứu sống bằng điều trị liều cao và ghép tế bào gốc tự thân. Brentuximab vedotin, một thuốc phối hợp chống CD30, có hiệu quả ở những bệnh nhân tái phát sau cấy ghép.
Theo dõi lâu dài cho thấy rõ ràng rằng các bệnh nhân chết vì các độc tính gây chết muộn liên quan đến xạ trị (nhồi máu cơ tim, đột quỵ, ung thư thứ phát) nhiều hơn so với bệnh Hodgkin. Có thể tránh phơi nhiễm phóng xạ bằng cách chỉ dùng hóa chất kết hợp trong giai đoạn sớm cũng như trong giai đoạn tiến triển.
