Đái tháo đường typ 1
Tăng triglycerid máu thấy trong giai đoạn đầu của đái tháo đường typ 1 là do giảm hoạt tính của lipoprotein lipase ở mô mỡ, hiện tượng này được khôi phục trong vòng 3 tháng sau khi bắt đầu điều trị. Tăng triglycerid máu do tăng mức VLDL-C thường xảy ra ở người mắc bệnh đái tháo đường typ 1 không quản lý được tốt glucose máu. Tăng triglycerid máu dai dẳng và mức HDL-C thấp cũng thường thấy ở những đối tượng kiểm soát kém glucose máu. Mức triglycerid hạ thấp nếu tình trạng kiểm soát glucose máu được cải thiện, đặc biệt khi mức glucose máu được bình thường hóa bằng sử dụng tiêm insulin dưới da liên tục hoặc tiêm nhiều mũi insulin.
Mức HDL-C cũng được cải thiện cùng với kết quả điều trị. HDL-C sẽ bình thường hoặc thậm chí tăng lên ở những người bệnh đái tháo đường typ 1 được quản lý tốt mức glucose máu. Người ta cũng thấy hoạt tính của lipoprotein lipase cũng bị giảm xuống ở những người bệnh đái tháo đường typ 1 có ceton niệu dù không có tình trạng nhiễm toan ceton lâm sàng.
Các nghiên cứu cũng chứng minh rằng cải thiện mức triglycerid trong điều trị tích cực là do giảm bài tiết VLDL-C, hơn là do tăng loại bỏ triglycerid khỏi huyết tương. Tương tự, giảm mức LDL-C thấy trong điều trị tích cực là do giảm sản xuất LDL-C. Giảm HDL-Cholesterol ở người bệnh đái tháo đường typ 1 không được điều trị một phần là do tăng dị hóa HDL-C kết hợp với tổn thương hoạt tính lipoprotein lipase. Những bất thường này sẽ trở lại bình thường theo kết quả của quá trình điều trị để cân bằng lượng glucose máu và các rối loạn chuyển hoá khác. Mức HDL-C tăng lên cũng thường gặp liên quan đến cân nặng tương đối thấp ở một số người bệnh đái tháo đường typ 1.
Nhưng rối loạn lipid chủ yếu ở người bệnh đái tháo đường typ 1, là lượng lipoprotein huyết tương thấp, là tăng mức LDL-C hạt nhỏ, đậm đặc. Tất cả các bất thường này sẽ được cải thiện song hành với mức kiểm soát glucose máu.
Đái tháo đường typ 2
Tác động của đái tháo đường typ 2 đối với lipid và lipoprotein khó được đánh giá hơn vì sự không đồng nhất của các yếu tố tham gia vào chu trình sinh bệnh học của bệnh, thậm chí cả vào phương pháp điều trị bệnh đái tháo đường như ảnh hưởng của kiểm soát glucose máu, hiệu ứng nhiễu của béo phì, tình trạng sử dụng các thuốc khác nhau cho các bệnh kết hợp và tác động của các biến chứng của bệnh.
Người bệnh đái tháo đường typ 2 chưa được dùng insulin hoặc thuốc uống hạ glucose máu thường có tăng triglycerid máu và có mức HDL-C thấp. Mức triglycerid huyết tương của họ tương quan nghịch với mức độ kiểm soát glucose máu. Bắt đầu sử dụng hoặc insulin hoặc các thuốc sulfamid làm hạ glucose máu, dẫn đến giảm mức VLDL-C và tăng HDL- c, còn nếu điều trị bằng metformin sẽ có giảm VLDL-C, nhưng thường không có tăng mức HDL-C.
Hiệu quả điều trị các rối loạn chuyển hoá lipid lớn hơn nhiều ở những người ngay từ đầu đã được điều trị đúng, kiểm soát glucose máu tốt, so với những người đã được điều trị từ trước, nhưng không đạt mục tiêu điều trị, nay được điều chỉnh lại.
Trong thực tế, tăng triglycerid máu và giảm mức HDL-C thường tồn tại ở người bệnh đái tháo đường typ 2 đã được điều trị và đôi khi không phụ thuộc vào mức độ kiểm soát glucose máu. Những bất thường còn lại này được gọi là rối loạn lipid trong đái tháo đường. Chúng bao gồm các hạt LDL-C nhỏ, đậm đặc; đây là sự tích luỹ tàn dư của các lipoprotein giàu triglycerid và các bất thường trong thành phần của HDL-C. Tăng triglycerid máu là kết quả của tăng bài tiết VLDL-C do quá trình dị hóa VLDL-C có thể bị tổn thương, mặc dù mức lipoprotein lipase vẫn bình thường. Trong trường hợp này phần nhiều là do hoạt tính của lipoprotein lipase bị giảm. ở những người bệnh dạng này thiếu hụt insulin thường chiếm ưu thế và luôn đi kèm với kháng insulin. Điều trị hoặc bằng insulin hoặc thuốc uống hạ glucose máu sẽ sửa chữa được những khiếm khuyết của lipoprotein lipase sau vài tuần đến vài tháng. Quá trình hồi phục này xảy ra song hành với giảm mức triglycerid huyết tương.
Các tàn dư của các lipoprotein giàu triglycerid thường tăng lên trong đái tháo đường typ 2. Đã có những nghiên cứu mà IDL (d=1.006- 1.019g/ml) được đo tách biệt với LDL-C (d=l.019-1.063g/ml). Kết quả cho thấy mức IDL giàu tàn dư tăng lên, trong khi mức LDL-C thực sự là bình thường, cả VLDL và IDL cũng được làm giàu bằng cholesterol, phù hợp với sự tích luỹ của các lipoprotein tàn dư. Đây là những sản phẩm góp phần làm tăng nguy cơ xơ vữa động mạch.
Chuyển hóa LDL-C cũng bị rối loạn ở những người bệnh đái tháo đường typ 2. Với đái tháo đường typ 2 nhẹ không được điều trị, các tốc độ tổng hợp và loại bỏ LDL cùng tăng lên đồng thời, dẫn đến mức LDL-C bình thường, ở những người bệnh có glucose máu tăng trung bình không được điều trị hoặc kiểm soát kém, tổn thương dị hóa LDL-C có thể dẫn đến tăng nhẹ mức LDL-C. Nhưng trong các trường hợp này, mối quan tâm hàng đầu lại là sự hiện diện của các LDL-C hạt nhỏ đậm đặc thường gặp trong đái tháo đường typ 2. Vai trò quyết định trong sinh bệnh học của hình thái bệnh lý này được gắn cho mức triglycerid huyết tương có tương quan nghịch với kích thước của các hạt LDL-C. Thậm chí ngay cả khi mức triglycerid huyết tương là tương đối thấp, các hạt LDL- c nhỏ đậm đặc cũng thường được tìm thấy ở người bệnh đái tháo đường typ 2. LDL-C có thể được tái cấu trúc thành hạt nhỏ hơn, đậm đặc hơn bởi lipase gan có thể tăng lên trong đái tháo đường typ 2. Kích thước hạt LDL-C cũng được chỉ ra có tương quan nghịch với mức độ của thành phần hemoglobin HbA1c.
Mức HDL-C giảm đi trong đái tháo đường typ 2 và tăng lên cùng với giảm cân, sử dụng insulin và sulfonylurea uống để làm hạ glucose máu. Như với đái tháo đường typ 1, điều này có thể một phần được giải thích bởi sự thay thế cholesterol trong nhân của HDL-C bằng triglycerid. Mức HDL-C tăng nếu mức triglycerid giảm trong khi điều trị, do sự đảo ngược của hiệu ứng này. Song mức HDL-C cũng có thể tăng lên trong thời gian điều trị, đó là kết quả của cải thiện dị hóa VLDL-C, với sự chuyển những thành phần bể mặt của VLDL-C sang HDL-C.
Acid béo, acid béo tự do và vấn đề kháng insulin
Thực nghiệm
- Truyền nhũ tương triacylglycerol sẽ thấy lượng acid béo tự do tăng nhanh nhưng lại ức chế thu nhận các glucose đã được insulin hoạt hóa.
- Dùng acipimox để hạ thấp nồng độ acid béo tự do trong máu sẽ làm tăng gấp 2 lần khả năng thu nhận glucose được insulin hoạt hóa.
- Tăng acid béo tự do gây ra khiếm khuyết vận chuyển hoặc phospholipid hoá biểu hiện bằng tốc độ thu nhận glucose được insulin hoạt hóa, tổng hợp glucogen, phân huỷ glucogen đều bị giảm mạnh.
Cơ chế kháng insulin
Một số acid béo tự do chuỗi dài làm giảm mức acid ribonucleic truyền tin của chất vận chuyển glucose đáp ứng với insulin, làm mất ổn định sự truyền tin của GLUT-4.
Acid béo tự do cũng làm thay đổi trạng thái lỏng của màng tế bào, làm thay đổi khả năng tiếp cận các thụ thể của insulin, thay đổi khả năng gắn và hoạt động của insulin.
Acid béo tự do và kháng insulin ở gan(hay kháng insulin trung tâm)
Liệu các acid béo tự do có gây đề kháng insulin ở gan? Câu hỏi này được đặt ra từ lâu. Hiện còn nhiều nghiên cứu cho các kết quả trái ngược nhau. Đó là do một số nguyên nhân sau:
- Tuy acid béo tự do thúc đẩy tân tạo glucose nhưng nó cũng kích thích bài tiết insulin để ức chế sản xuất glucose nội sinh.
- Chưa có bằng chứng thuyết phục và cơ chế tự điều hoà glucose ở gan cũng còn nhiều vấn đề chưa được sáng tỏ. (Cơ chế này giả định khi lượng glucose nội sinh tăng thì gan giảm phân giải glycogen và ngược lại).
Acid béo tự do và bài tiết insulin
Về mặt lý thuyết, thông thường khi nồng độ acid béo tự do tăng lên sẽ được cân bằng cách hoặc bằng tăng insulin máu, hoặc bằng tăng glucose máu hoặc là cả hai. Nhưng may thay là cơ thể lại chọn cách đáp ứng đầu tiên vì acid béo tự do là những chất kích thích bài tiết insulin mạnh, mà không chọn phương pháp đáp ứng bằng tăng glucose máu. Trên thực nghiệm người ta thấy in vitro acid béo tự do đã kích thích bài tiết insulin kéo dài đến 72 giò; còn in vitro kéo dài kích thích đến 48 giò.
Người ta cũng đã dùng acipimox (chất tương tự như nicotinic) làm giảm 60-70% acid béo tự do thấy giảm khoảng 50% mức insulin ở tất cả các đối tượng người bình thường, người đái tháo đường typ 2, người béo phì. Như vậy, acid béo tự do đảm bảo điều hoà từ 30-50 % mức insulin cơ sở.
Các acid béo tự do ở người đái tháo đường typ 2
Khi nồng độ acid béo tự do tăng khoảng 100 p.M (micromol) thì mức đề kháng insulin tăng khoảng 5-10%. ở người không đái tháo đường nhưng có thừa cân, béo phì, tăng insulin máu là đáp ứng sinh lý với mức tăng các acid béo tự do. Phản ứng này ở người đái tháo đường lại khác (hình 4.1) đó là do:
- Người đái tháo đường có khả năng bài tiết insulin kém trong đáp ứng với hiện tượng tăng acid béo tự do. Điều này làm mối tương quan giữa tỷ lệ “đề kháng – bài tiết” insulin trở nên bất bình thường.
- Người đái tháo đường cần có sự gia tăng glucose máu lớn hơn nhiều lần so với đối tượng không bị đái tháo đường để bù cho kháng insulin.
- ở người đái tháo đường, acid béo tự do có khả năng làm tăng sản xuất glucose nội sinh cao hơn so với người không bị đái tháo đường.
Nhiều nghiên cứu cho thấy trong điều kiện glucose máu bình thường với mức acid béo tự do tương đương (<100pM/l) khả năng thu nhận glucose được insulin hoạt hóa cao hơn gấp hai lần so với người đái tháo đường typ 2 có béo phì. Người ta thấy acid béo tự do có tham gia vào quá trình đề kháng insulin có ở 50% người bệnh đái tháo đường typ 2 có kháng insulin.
Từ những kết quả nghiên cứu này có thể đặt giả thuyết rằng: ở những người béo phì – mà hiện nay được xem là đối tượng có khả năng “đương nhiên” tiến tối mắc bệnh đái tháo đường typ 2, nếu có acid béo tự do huyết tương tăng, thường gọi là “mù lipid bán phần”- sẽ có hiện tượng bất thường trong tỷ lệ “đề kháng – bài tiết” insulin tăng dần theo thời gian. Có nhiều ý kiến cho rằng hiện tượng này xảy ra còn là do khiếm khuyết di truyền của tế bào beta.
Đồng thời với quá trình trên là quá trình “mù glucose” do những khiếm khuyết trong đáp ứng của tế bào beta với sự tăng glucose máu. Giai đoạn cuối của hai quá trình “mù lipid bán phần” và “mù glucose” là biểu hiện bệnh lý của đái tháo đường lâm sàng.
Như vậy tăng acid béo tự do sẽ ức chế thu nhận các glucose được insulin hoạt hóa hay nói cách khác là đã gây ra đề kháng insulin ngoại vi. Để cải thiện tình trạng đề kháng insulin ngoại vi buộc phải làm giảm nồng độ acid béo tự do, điều này sẽ cải thiện độ nhạy của insulin ở mô ngoại vi. Đây là hướng nghiên cứu quan trọng trong việc hạn chê các yếu tố nguy cơ dẫn đến tăng tỷ lệ đái tháo đường typ 2. Nhưng để hoàn thiện giả thuyết này, một câu hỏi đặt ra cần phải được trả lòi đó là: Hiện tượng “mù lipid bán phần” của tế bào beta là một khiếm khuyết “tiên phát” hay “thứ phát”?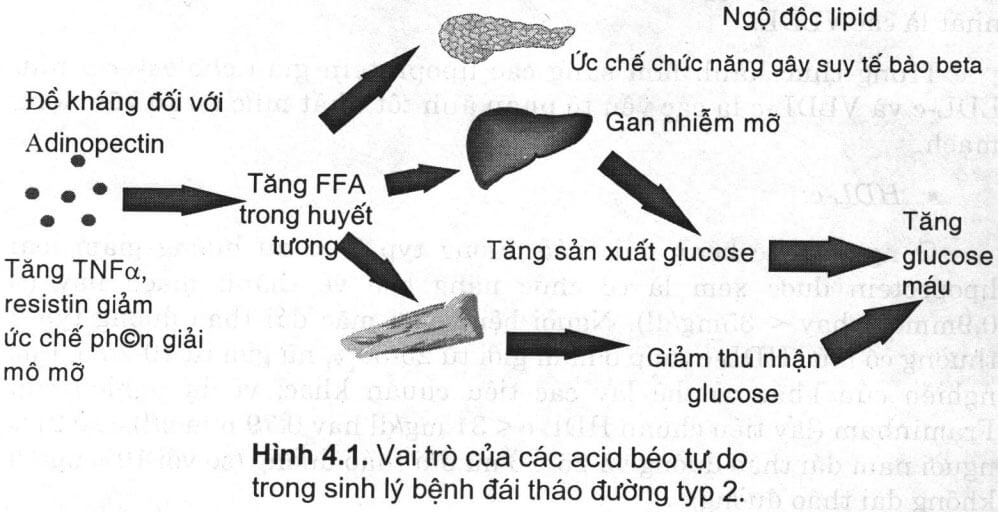
Hình 4.1. Vai trò của các acid béo tự do trong sinh lý bệnh đái tháo đường typ 2.
Ghi chú: FFA – acid béo tự do.
Hình thái rối loạn lipid máu ở người bệnh đái tháo đường typ 2
Các lipoprotein giàu cholesterol
- LDL-C:
Có vai trò đặc biệt quan trọng trong bệnh lý tim mạch. Nếu lấy tiêu chuẩn LDL-C trong máu trên 160mg/dl (4,lmmol/l) là bệnh lý thì ở người mắc bênh đái tháo đường tỷ lê tăng LDL-C ở nam là 10% và nữ là 25%.
Tuy nhiên trong thực tế LDL-C không có sự khác biệt ở người đái tháo đường so với người không đái tháo đường, mà thường là các mảnh LDL-C nhỏ, nặng tăng nhiều hơn (biểu hiện bằng tăng apo-protein B). nhưng có điều cần nhớ là ở người đã mắc bệnh đái tháo đường typ 2, chỉ cần LDL-C tăng nhẹ hoặc trung bình cũng đã là yếu tố nguy cơ làm cho bệnh lý mạch vành tăng lên rõ rệt.
- VLDL:
Là các LDL-C nhỏ, nặng và có vai trò đặc biệt trong bệnh lý mạch máu. Nhưng rất khó định lượng được. Đây cũng là lý do để khái niệm “cholesterol không HDL” ra đời.
Nghiên cứu UKPDS cho thây, LDL-C là yếu tố nguy cơ quan trọng nhất trong nhóm nguy cơ của rối loạn chuyển hoá lipid gây tăng bệnh lý mạch vành. Vai trò của các lipoprotein giàu cholesterol khác trong bệnh lý đái tháo đường typ 2 đều có khả năng làm tăng tỷ lệ xơ vữa mạch nhất là các VLDL.
Trong thực hành lâm sàng các lipoprotein giàu cholesterol như LDL-C và VLDL-C là các yếu tố phản ánh tốt nhất mức độ xơ vữa động mạch.
- HDL-C:
ở người mắc bệnh đái tháo đường typ 2 có xu hướng giảm loại lipoprotein được xem là có chức năng bảo vệ thành mạch này (< 0,9mmol/l hay < 35mg/dl). Người bệnh mới mắc đái tháo đường typ 2 thường có mức HDL-C thấp ở nam giới từ 25-50%, nữ giới từ 10-25%. Các nghiên cứu khác có thể lấy các tiêu chuẩn khác; ví dụ nghiên cứu Framinham (lấy tiêu chuẩn HDL-C < 31 mg/dl hay 0,79 mmol/l) có ở 21% người nam đái tháo đường và 25% ở nữ đái tháo đường (so với 10% người không đái tháo đường).
Lipoprotein giàu triglycerid
ở nam tỷ lệ thành phần này là 19% (so với người không đái tháo đường là 9%).
ở nữ tỷ lệ thành phần này là 20% (so với người không đái tháo đường là 8%).
Tỷ lệ triglycerid >200mg/dl (>2,3mmol/l) ở phụ nữ đái tháo đường chiếm 17% (so với 8% nữ không đái tháo đường). Tăng triglycerid ở người đái tháo đường typ 2 có thể biểu hiện qua tăng các chylomicron VLDLs, IDL (Intermediate – density lipoprotein).
Các chỉ số để đánh giá
- Tỷ lệ TC/HDL (Cholesterol toàn phần/ HDL).
- Tỷ lệ LDL/HDL.
- TC (Cholesterol toàn phần).
- TG (Triglycerid).
- Cholesterol không HDL: Đây là một khái niệm mới dùng để đánh giá lượng cholesterol không phải HDL-C. Tốt nhất là < 3,4 mmol/l.
Hội chứng đề kháng insulin/béo trung tâm và rối loạn lipid máu
Kháng insulin là một đặc điểm thường gặp của người mắc bệnh đái tháo đường typ 2 có thừa cân, béo phì, nhưng hiện tượng này cũng xảy ra ở những cá thể có mức glucose máu bình thường. Trong cả hai tình huống đều có sự tụ tập các yếu tố nguy cơ và tăng rõ rệt bệnh lý tim mạch.
Những yếu tố nguy cơ này bao gồm rối loạn lipid máu (gồm tăng triglycerid máu, HDL-C thấp, tích tụ lipoprotein tàn dư, sự có mặt của các hạt LDL-C nhỏ đậm đặc, VLDL-C), tăng huyết áp, rối loạn dung nạp glucose, tăng mức íĩbrinogen và yếu tố hoạt hóa plasminogen mô, giảm mức chất ức chế-1 của chất hoạt hóa plasminogen.
Đây là nhóm các yếu tố tập hợp thành Hội chứng X. Điểm xác nhận của hội chứng này là hiện diện của sự phân bố mỡ của cơ thể tập trung ở trung tâm, đặc biệt ở các tạng, mà có thể phát hiện được bằng chụp cắt lớp điện toán ổ bụng.
Các khiếm khuyết phân tử gây ra hội chứng này hiện nay chưa được biết. Một giả thiết cho rằng khiếm khuyết tiên phát là đề kháng insulin, tuy nguyên nhân và bản chất của (các) khiếm khuyết này chưa được nghiên cứu tường tận. Có khả năng hơn là tăng insulin máu là thứ phát do tăng mỡ tích tụ ở tế bào không phải tế bào mổ ở phủ tạng. Tăng insulin xảy ra trong bất kỳ trường hợp nào được cho là dẫn đến tất cả các đặc điểm khác của hội chứng, bao gồm rối loạn lipid máu. Tăng bài tiết VLDL apolipoprotein B (apo B) được cho là có liên quan đến tăng dòng đến của acid béo tự do ở hệ tĩnh mạch cửa, cũng có thể kích thích hoạt tính của các men lipase gan. Điều này đến lượt nó lại dẫn đến giả thuyết về sự hình thành các LDL-C nhỏ hạt, đậm đặc.
Biến chứng
Biến chứng ở thận
Biến chứng chủ yếu của đái tháo đường ảnh hưởng đến lipoprotein là bệnh thận. Các đốĩ tượng đái tháo đường có microalbumin niệu, nhưng chức năng thận vẫn bình thường, đều có mức triglycerid và apo B cao hơn những đối tượng không có microalbumin niệu kết hợp.
Ở người bệnh đái tháo đường typ 1 nếu có albumin niệu kết hợp với sự gia tăng tiếp theo về mức apo B, thì nguy cơ bệnh tim mạch tăng rõ rệt. Một sự gia tăng phần IDL giàu tàn dư cũng có ở những bệnh nhân đái tháo đường typ 1 có albumin niệu. Khi protein niệu rõ rệt và/hoặc có hội chứng thận hư, thì cả mức VLDL-C và LDL-C đều tăng lên rõ rệt;
điều này tương tự như ở các bệnh nhân mắc hội chứng thận hư không bị đái tháo đường. Người ta cũng thấy rằng bệnh thận giai đoạn cuối, có tăng triglycerid máu và mức HDL-C thấp là đặc trưng cho cả người đái tháo đường và không đái tháo đường.
Người bệnh đái tháo đường typ 1 luôn có khả năng tăng tỷ lệ mắc mới các bệnh tự miễn của tuyến giáp. Suy giáp không được điều trị có thể dẫn đến tăng cả LDL-C, VLDL-C, các chỉ số này sẽ trở về mức bình thường nhờ điều trị thay thế bằng các hormon giáp. Một số thuốc sử dụng để điều trị tăng huyết áp, đặc biệt là các thuốc lợi tiểu và chẹn (3 giao cảm có thể tác động theo chiều hướng bất lợi đến chuyển hoá lipid và lipoprotein huyết tương.
Hội chứng chylomicron máu
Hội chứng chylomicron máu xảy ra khi mức triglycerid huyết tương vượt quá 2.000mg/dl (trên 22,6 mmol/l); được đặc trưng bởi sự tập hợp các dấu hiệu và các triệu chứng bao gồm nổi u vàng, đau bụng và viêm tụy, tăng mỡ máu biểu hiện võng mạc, mất trí nhớ và loạn cảm giác.
Thường gặp nhất của tăng triglycerid máu nặng ở mức độ này là ở những người mắc bệnh đái tháo đường typ 2 không được điều trị, kết hợp với dạng di truyền của tăng triglycerid máu gia đình. Mức triglycerid rất cao là kết quả bão hòa của sự loại bỏ triglycerid qua trung gian lipoprotein lipase và bài tiết quá mức VLDL xảy ra trong đái tháo đường. Tổn thương hoạt tính lipoprotein lipase thứ phát sau thiêu hụt insulin, hoặc tương đối trong đái tháo đường typ 2, hoặc tuyệt đối trong đái tháo đường typ 1 có thể tiếp theo đó làm giảm khả năng phân giải các triglycerid khỏi huyết tương.
Đái tháo đường và các biến đổi của lipoprotein
Đái tháo đường có thể dẫn đến một số biến đổi của các lipoprotein, thậm chí có thể tác động đến sự tương tác của chúng với các tế bào nội mô của thành động mạch. Chính bằng cách này chúng đã đóng góp vào quá trình làm tăng nguy cơ xơ vữa động mạch trong trường hợp mắc bệnh đái tháo đường. Hai quá trình có thể làm biến đổi các lipoprotein có thể xảy ra trong đái tháo đường cả typl và typ 2 là quá trình oxy hóa và glycat hóa.
Các lipoprotein oxy hóa
Ngày càng có nhiều bằng chứng về sự rối loạn cân bằng giữa sản sinh các gốc tự do và bảo vệ chống oxy hóa trong sinh bệnh học của bệnh đái tháo đường. Tự oxy hóa ‘glucose và glycat hóa các protein dẫn đến sản sinh các gốc oxy tự do thúc đẩy peroxid hóa lipid và oxy hóa LDL-C. Qúa trình tự bảo vệ chống oxy hóa cũng bị giảm xuống trong cả typ 1 và typ 2 của đái tháo đường, bao gồm giảm mức vitamin c, một chất đóng vai trò trong bảo vệ lipid và lipoprotein khỏi bị biến đổi trong quá trình oxy hóa. Vì oxy hóa các lipoprotein được cho là xảy ra trong khoảng kẽ nhiều hơn là trong tuần hoàn, nên người ta chỉ sử dụng các phép đo gián tiếp để đánh giá. Kết quả nghiên cứu cho thấy, LDL-C được phân lập từ các đối tượng bị đái tháo đường typ 1 và typ 2 kiểm soát kém, nhạy cảm hơn với biến đổi oxy hóa so với LDL-C từ đối tượng không bị đái tháo đường trong nhóm chứng. Ngược lại, LDL-C từ các bệnh nhân đái tháo đường typ 1 được kiểm soát tốt không có tăng nhạy cảm với biến đổi oxy hóa. Người ta cũng thấy tính nhạy cảm của LDL-C với oxy hóa đã được chứng minh là liên quan nghịch với mức độ kiểm soát glucose máu trong đái tháo đường typ 2. Thêm vào đó, các LDL-C nhỏ đậm đặc, đặc trưng trong đái tháo đường typ 2 và tình trạng kháng insulin cũng bị oxy hóa dễ dàng hơn so với LDL-C ít đậm đặc hơn. Tuy thậm chí oxy hóa lipoprotein được cho là xảy ra ngoài mạch máu nhưng một số nghiên cứu trên động vật và người bị đái tháo đường đã chứng minh rằng lipoprotein lưu hành có tăng oxy hóa. Bằng chứng tiếp theo của oxy hóa lipoprotein xảy ra in vivo là việc phát hiện các tự kháng thể lưu hành chống LDL-C đã bị oxy hóa. Những chất này có thể đóng vai trò trong sinh lý bệnh xơ vữa động mạch. Các kháng thể lưu hành giúp nhận diện được LDL-C đã bị oxy hóa, có ý nghĩa dự báo sự phát triển bệnh mạch vành trong đái tháo đường typ 1. Trong đái tháo đường 2 có sự khác biệt, các tự kháng thể mà phản ứng với LDL-C bị oxy hóa không có ý nghĩa dự báo, người ta thấy sự có mặt của các kháng thể này cũng không có mối liên quan với bệnh mạch vành.
Các lipoprotein glycat hóa
Một biến đổi khác của các lipoprotein thường gặp ở cả hai typ đái tháo đường có liên quan đến mức độ kiểm soát glucose máu mạn tính là glycat hóa không enzyme. Glycat hóa các apolipoprotein trong tất cả các lổp của lipoprotein lưu hành đã được tìm thấy trong đái tháo đường.
Khoảng 2% – 5% của apo B trong huyết tương của người mắc bệnh đái tháo đường bị glycat hóa so với khoảng 1% trong huyết tương của nhóm chứng không bị đái tháo đường. Khoảng 20% LDL-C bị glycat hóa ở các đối tượng đái tháo đường typ 1 kiểm soát kém, so với 5% ở những cá thể không bị đái tháo đường. Tăng glycat hóa các apolipprotein c lưu hành có khả năng là phản ánh của sự gia tăng thời gian lưu lại trong huyết tương của chúng so với VLDL-C và HDL-C mà giữ chúng apolipoprotein c. Các sản phẩm cuối của gỊycat hóa cao (AGE) cũng đã được thấy là có kết hợp với LDL-C, với sự biến đổi của các nhóm amin trên cả hai protein và phospholipid. Quan sát này đưa đến giả thuyết rằng sự tạo thành AGE có thể xảy ra nhanh hơn người ta nghĩ trước đây, hoặc AGE-LDL-C có thể đi vào huyết tương từ những mô ngoài mạch máu như thành động mạch. Cũng như với LDL-C bị oxy hóa, các tự kháng thể lưu hành chống LDL-C bị glycat hóa đã được chứng minh là có tồn tại ở một số người bệnh bị đái tháo đường.
LDL-C nhỏ đậm đặc và sự làm giàu cholesterol bề mặt
Một số thay đổi trong thành phần của các lipoprotein có thể làm thay đổi tương tác của chúng với các tế bào nội mô đã được mô tả trong đái tháo đường. Đái tháo đường điều trị bằng liệu pháp insulin tích cực, không chỉ tình trạng glucose máu được quản lý tốt, tình trạng chuyến hoá lipid cũng đã khá lên nhiều, biểu hiện bằng có tăng tương đối tỷ số cholesterol không este hóa/phospholipid trong tất cả các nhóm lipoprotein. Những rối loạn về thành phần lipoprotein tuy được cải thiện khi được điều trị tốt, nhưng vẫn tồn tại những yếu tố gây ra những rối loạn cần được khắc phục.
Như đã được thảo luận trên đây, đái tháo đường typ 2 và các tình trạng đề kháng insulin được đặc trưng bởi sự có mặt của các LDL-C nhỏ đậm đặc, CÓ tính nhạy cảm tăng với quá trình biến đổi oxy hóa. Người ta cũng còn gặp các lipoprotein giàu triglycerid có thể được làm giàu với Apo E ở người mắc bệnh đái tháo đường.
Như vậy một số thay đổi, dù nhỏ trong thành phần các lipoprotein có thể xảy ra trong đái tháo đường, đã có thể ảnh hưởng đến quá trình tương tác của chúng với các tế bào nội mô, làm tăng xu hướng xơ vữa động mạch trong bệnh đái tháo đường.
Các lipoprotein trong sinh bệnh học xơ vữa động mạch
Các lipid và lipoprotein tham gia vào tất cả các giai đoạn của xơ vữa động mạch. Tổn thương sớm nhất của xơ vữa động mạch là các tổn thương nội mạc bị xâm lấn bởi các đại thực bào chứa đầy cholesterol, thường được xem như các “vết md bẩn” để lại trên bề mặt của lớp tế bào nội mô. Các lipoprotein lưu hành đi vào khoảng dưới nội mạc bằng cách xuyên bào, sau đó chúng gắn vào và được giữ lại bởi các proteoglycan mạch. Một khi được giữ lại, chúng có khả năng biến đổi oxy hóa. Tuy hầu hết các nghiên cứu tập trung vào LDL-C oxy hóa, VLDL-C và lipoprotein nối apo-Lp(a) cũng có thể bị oxy hoá bởi các tế bào nội mạc, các tế bào cơ trơn và các đại thực bào theo những con đường khác nhau. Các cơ chế này đòi hỏi sự có mặt của các yếu tố chuyển tiếp, bao gồm quá trình sản sinh ra superoxid với sự tham gia của các lipoxygenase. Các bạch cầu đơn nhân – đại thực bào cũng có thể làm thay đổi oxy hóa LDL-C bằng myeloperoxidase mà không đòi hỏi các yêú tố chuyển tiếp. Các LDL-C bị oxy hóa có thể tác động vào nhiều quá trình sinh học. Thông qua các quá trình này LDL-C bị oxy hoá có thể tham gia sớm vào quá trình hình thành các mảng xơ vữa mạch.
Như vậy, xơ vữa mạch là một quá trình khởi đầu là gắn kết và hóa ứng động các bạch cầu đơn nhân đến các tế bào nội mạc, hoạt hóa và biệt hóa các bạch cầu đơn nhân – đại thực bào bởi các yếu tố kích thích dòng, bằng cách này tạo thuận lợi cho quá trình thu nạp, hoạt hóa và trưởng thành của các đại thực bào. Các LDL-C bị oxy hóa có thể bị thu nạp bởi một số thụ thể của đại thực bào, bao gồm SR-Al, CD-36 và macrosalin, dẫn đến sự hình thành các tế bào bọt chứa đầy lipid.
Trong thời gian tiến triển từ vết mỡ đến mảng xơ mỡ, các tế bào cơ trơn “di cư” từ lớp trung mạc vào lốp nội mạc mạch. Ớ đây chúng tăng sinh trong quá trình đáp ứng với một số cytokin và các yếu tố tăng trưởng. Các lipoprotein bao gồm cả LDL-C oxy hóa có thể làm thay đổi hoạt động của một số yếu tố tăng trưởng và vì thế cũng ảnh hưởng đến giai đoạn này của xơ vữa động mạch. Cholesterol xuất xứ từ lipoprotein cũng có thể tích luỹ trong các tế bào cơ trơn của động mạch theo các cơ chế còn chưa được biết rõ. Các tế bào cơ trơn thường có thể tích luỹ lipid mà không cần sự tham gia của các thụ thể LDL-C chức năng (ví dụ như trong tăng cholesterol máu gia đình đồng hợp tử). Sự thu nhận còn có thể qua trung gian tương tác với các proteoglycan bề mặt tế bào, thu nhận chọn lọc từ các lipoprotein hoặc bằng sự chuyển vị trực tiếp của cholesterol không este hóa từ các lipoprotein đến bề mặt các tế bào cơ trơn của động mạch. Các lipoprotein cũng tích luỹ ngoài tế bào trong môi kêt hợp với các phân tử nền, mà các lipoprotein chứa apo B và apo E và Lp(a) gắn vào với ái lực cao.
Tích luỹ một khối lượng lớn các chất nền ngoại bào và mô xơ là một dấu hiệu quan trọng khác để đánh giá tổn thương xơ vữa động mạch. Tổn thương xơ vữa cũng có thể bị ảnh hưởng bởi các lipid và các lipoprotein, bởi vì sự bài tiết các proteoglycan bởi các tế bào cơ trơn động mạch có thể bị thay đổi do sự phơi nhiễm của chúng với các lipoprotein. Như thế, các lipoprotein chứa apo B và apo E có thể tham gia vào chu trình sinh bệnh học của mảng xơ vữa.
Sự tích luỹ cholesterol trong máu là biểu hiện cân bằng giữa hai quá trình thu nhận và loại bỏ cholesterol. Trong quá trình này có vai trò quan trọng của các HDL-C. Gắn HDL-C vào các vị trí gắn bề mặt của tế bào làm khởi phát sự chuyển vị của cholesterol từ kho nội bào ra bề mặt tế bào, mà từ đó nó có thể bị loại bỏ bởi các hạt nhận, nhiều khi là chính các HDL-C. Các vị trí gắn HDL-C trên bề mặt tế bào tăng lên trong đáp ứng với sự tích tụ của cholesterol, điều này tạo ra một cơ chế thuận lợi cho tế bào loại bỏ lượng cholesterol dư thừa. Cholesterol sau đó bị este hóa, chuyển đến các lipoprotein có tỷ trọng thấp hơn và được vận chuyển đến gan mà từ đó nó có thể được bài tiết trong một quá trình được gọi là vận chuyển ngược cholesterol. Như thế, các hạt HDL-C có thể tạo ra điều kiện thuận lợi để loại bỏ cholesterol dư thừa từ các tế bào của thành động mạch. Giả thuyết này còn được xem là cơ chế bảo vệ thành mạch cua HDL-C.
Lp(a) là một lipoprotein cấu tạo từ một hạt LDL-C trong cầu nối disulíìd với apo (a), một protein có sự tương tự về trình tự với plasminogen mà không có chức năng protease. Lp(a) có thể bị biến đổi oxy hóa, gắn vào chất nền ngoại bào và bị thu nhận bởi các đại thực bào cơ chế thu nhận này chưa được chứng minh rõ ràng. Với chức năng này Lp(a) có thể phân phát cholesterol cho thành động mạch và vì thế nó được xem là có tính chất sinh xơ vữa. Lp(a) cạnh tranh vị trí gắn với plasminogen, nhưng không gây tan huyết khối, mà ngược lại Lp(a) còn có khả năng gây huyết khối; chính bởi vậy Lp(a) có thể làm tăng nguy cơ xơ vữa động mạch, bên cạnh khả năng gây huyết khối đã được chứng minh, nhất là khi kết hợp với tăng triglycerid máu.
Các mảng xơ vữa luôn có xu hướng hoại tử và theo sau là xuất huyết vào mảng xơ vữa. Qúa trình này có thể dẫn đến vỡ mảng và tạo khuyết khối trong mạch mà hậu quả là nhồi máu cơ tim, tắc mạch não gây đột quỵ, bệnh mạch máu ngoại vi v.v.
Cũng còn có sự tích tụ các lipoprotein chứa apo B gây xơ vữa và giảm HDL-C bên cạnh vai trò của LDL nhỏ đậm đặc luôn kết hợp với tăng nguy cơ xơ vữa động mạch và dễ bị oxy hóa. Trong bệnh đái tháo đường, stress oxy hóa tăng lên đồng thời với tăng xu hướng oxy hóa các LDL-C. Ngoài ra, mức glucose lưu hành cao trong máu cũng là điều kiện thuận lợi cho glycat hóa và các con đường oxy hóa glucose, dẫn đến sự hình thành các sản phẩm AGE khác nhau.
LDL-C glycat hóa tương tác kém với thụ thể LDL-C, bằng cách này làm tăng thời gian lưu trú của nó trong huyết tương và có lẽ là trong khoảng ngoại bào ở đó quá trình oxy hóa có thể xảy ra. Một số nghiên cứu cũng thấy rằng LDL-C glycat hóa làm tăng tính nhạy cảm với biến đổi oxy hóa.
HDL-C glycat hóa bị tổn thương khả năng kích thích dòng cholesterol ra khỏi tế bào, làm thuận lợi cho sự vận chuyển cholesterol ester đến các lipoprotein chứa apo B. Thêm vào đó, các protein AGE với những thụ thể của chúng có thể gây ra stress oxy hóa, làm tăng biểu lộ của các phân tử kết dính trên các tế bào nội mạc và làm thuận lợi cho hóa ứng động các bạch cầu đơn nhân. Hơn nữa các protein AGE có thể kích thích giải phóng các cytokin và các yếu tố tăng trưởng khác. Tất cả các yếu tố này đều có thể có những vai trò khác nhau trong quá trình tạo ra mảng xơ vữa.
Như thế, có nhiều con đường khác nhau, có thể thúc đẩy nhiều bước trong sinh bệnh học xơ vữa động mạch.
Có thể coi các lipoprotein bị biến đổi như kết quả của đái tháo đường. Sau đó chính sự thay đổi này có thể lại là nguyên nhân gây ra hình thành các tự kháng thể và các phức hợp miễn dịch. Các tự kháng thể và các phức hợp tự miễn dịch này đã gây ra hậu quả thế nào còn chưa được nghiên cứu; nhưng có điều chắc chắn là sau đó nó bị tiêu diệt bởi các đại thực bào. Sự thực bào cũng là bước đầu tiên của quá trình tích tụ lipid, rồi tạo thành tế bào bọt trong các đại thực bào. Các phức hợp miễn dịch lipoprotein, ví dụ như với kháng thế kháng LDL-C oxy hóa hoặc glycat hóa cũng có thể dẫn đến sự hình thành tế bào bọt sau thực bào bởi các thụ thể Fc trên các đại thực bào. cả hai quá trình này có thể tăng lên trong đái tháo đường.
Sự tích tụ các LDL-C có thể xảy ra như kết quả của quá trình oxy hóa hoặc do hoạt động của sphingomyelinase trong thành động mạch.
Các lipoprotein bị biến đổi cũng còn có thể làm thuận lợi cho quá trình xơ vữa động mạch trong trong bệnh đái tháo đường theo một số cơ chế bổ sung. Ví dụ, những thay đổi thành phần trên bề mặt hạt lipoprotein làm thuận lợi cho dòng cholesterol vào tế bào hơn là theo hướng ngược lại; điều này có thể gây ra tích tụ lipid tế bào. P-VLDL-C, một lipoprotein tàn dư, thường được tạo thành trong quá trình đáp ứng của cơ thể với thức ăn giàu chất béo và cholesterol, cũng là yếu tố dẫn đến tích tụ cholesterol trong các đại thực bào. Một cơ chế tương tự có thể giải thích cho sự gia tăng thu nhận các lipoprotein giàu triglycerid và các tàn dư của chúng, thường gây tích tụ trong đái tháo đường. Ta có thể dễ dàng nhận thấy những yếu tố này đều làm thuận lợi cho việc hình thành các tế bào bọt.
Như thế, nhiều thay đổi về thành phần và số lượng của các lipoprotein thường gặp trong cả 2 typ đái tháo đường có thể ảnh hưởng đến nhiều vị trí trong sinh bệnh học xơ vữa động mạch.
