Tinh bột
Tinh bột là sản phẩm quang hợp của cây xanh. Ở trong tế bào thực vật hạt lạp không màu là nơi tạo ra tinh bột, các glucid hòa tan kéo đến hạt lạp không màu và được để dành dưới dạng tinh bột. Tinh bột được giữ lại trong các bộ phận của cây như củ, rễ, quả, hạt, thân với hàm lượng từ 2-70%, trong lá thường không quá 1-2%. Tinh bột ở dưới dạng hạt kích thước và hình dáng khác nhau, không tan trong nước lạnh, đun với nước thì tinh bột dần dần bị hồ hóa và độ nhớt của dung dịch cũng tăng lên. Trong quá trình hoạt động của cây, tinh bột dưới tác động của enzym có sẵn trong cây bị cắt nhỏ thành những đường đơn giản ở dạng hòa tan và được chuyển đến những bộ phận khác nhau của cây.
I. CẤU TRÚC HÓA HỌC CỦA TINH BỘT.
Tinh bột được cấu tạo bởi 2 loại polysaccharid được gọi là amylose và amylopectin..
Amylose: phân tử amylose là một chuỗi hiện nay được biết đến hàng nghìn đơn vị β-D-glucose nối với nhau theo dây nối (1-> 4). Quan niệm trước đây cho rằng chỉ có từ 200-400 đơn vị vì do quá trình chiết xuất và phân tích, mạch bị đứt. Phân tử amylose đa số là các chuỗi thẳng rất ít phân nhánh.
. Chú thích về ký hiệu viết tắt các đường trong chương carbohydrat và chương glycosid: arb = arabinose, ara(f) = arabinofuranose, ara(p) = arabinopyranose, api = apiose, boi = boivinose, cym = cymarose, digin = diginose, digita = digitalose, digt = digitoxose, fuc= fucose, gal(p) = galactopyranose, gita= gitalose, glc= glucose, glcA = acid glucuronic, oleand = oleandrose, prim = primeverose, rha = rhamnose, rha(p) = rhamnopyranose, xyl = xylose
Công thức lập thể của các đơn vị glucose thì có tài liệu cho rằng ở dạng ghế C1 nhưng cũng có tài liệu cho rằng ở dạng thuyền B1 nối với nhau tạo thành các vòng xoắn, mỗi vòng có 6 đơn vị glucose.
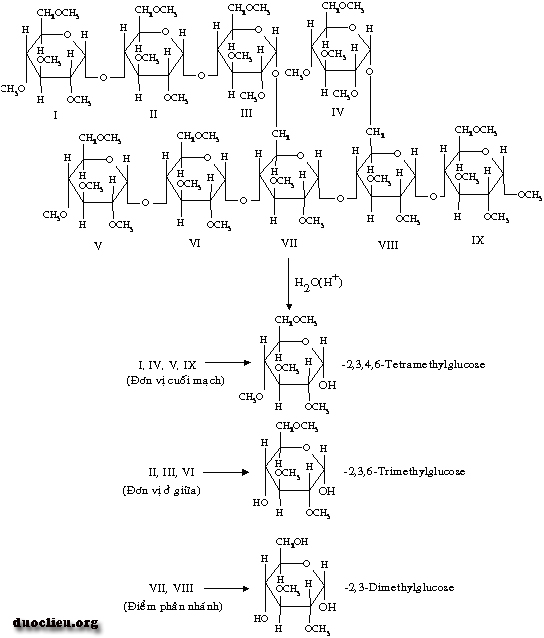
Amylopectin: amylopectin có phân tử lượng lớn hơn khoảng 106-107 gồm 5000-50.000 đơn vị glucose và phân nhánh nhiều. Các đơn vị α-D-glucose trong mạch cũng nối với nhau theo dây nối (1-> 4) còn chỗ phân nhánh thì theo dây nối (1-> 6). Để xét mức độ phân nhánh, người ta methyl hóa toàn bộ các nhóm OH của amylopectin rồi sau đó thủy phân và suy ra từ lượng 2, 3 dimethylglucose. Lượng 2, 3, 4, 6 tetramethylglucose ứng với những đơn vị tận cùng của mạch còn lượng 2, 3, 6 trimethylglucose ứng với những đơn vị glucose trong mạch.
Ngoài ra còn có thể xác định lượng glucose cuối mạch dựa vào tính khử của amylopectin không methyl hóa. Chú ý rằng ở đây là glucose ở cuối mạch có OH bán acetal tự do. Mạch bên trong (mạch giữa 2 điểm phân nhánh) của amylopectin có khoảng 5-9 đơn vị glucose, những mạch bên ngoài có từ 10-18 đơn vị. Trong các loại tinh bột, trung bình tỉ lệ amylose là 25% còn amylopectin là 75%. Tuy nhiên người ta cũng tạo ra được những chủng có nhiều amylose, ví dụ ngô, có tinh bột chứa 75% amylose.
Amylose cho với thuốc thử iod màu xanh đậm có cực đại phổ hấp thu khoảng 660nm, còn amylopectin thì có màu tím đỏ và cực đại hấp thụ khoảng 540nm. Màu tạo thành giữa tinh bột và iod được giải thích do sự hấp phụ. Người ta cho rằng iod bị hấp phụ vào phía trong hình xoắn ốc. Ứng với một vòng xoắn ốc thì có 1 phân tử iod. Những phân tử chưa đủ 6 đơn vị glucose thì không phản ứng với iod.
II. SỰ THỦY PHÂN TINH BỘT
Khi thủy phân tinh bột bằng acid thì sản phẩm cuối cùng là glucose
C6H12O6 (C6H10O5)n + nH2O -> (1+n) (C6H12O6)
Sự thủy phân qua các chặng: dextrin, erythrodextrin, achrodextrin, maltose, glucose. Amylose dễ bị thủy phân hơn amylopectin vì dây nối (1-> 4) dễ bị cắt hơn là dây nối (1-> 6).
Thủy phân bằng enzym
Enzym amylase. Có 2 loại chính: a-amylase và β-amylase. Enzym a phổ biến trong cây, nhiều nhất là các hạt ngũ cốc nẩy mầm, ngoài ra còn có trong nấm mốc, nước bọt, dịch tụy. a -amylase chịu được nhiệt độ đến 70o, ở nhiệt độ này thì các enzym khác mất hoạt tính. Enzym β-amylase có trong khoai lang, đậu nành và một số hạt ngũ cốc, chịu được nhiệt độ đến 50o nhưng chịu được môi trường acid cao hơn so với enzym a (pH = 3,3). Trong thực tế người ta dựa vào ảnh hưởng khác nhau đó về độ pH và nhiệt độ để tách 2 loại enzym trên. Khả năng tác dụng lên 2 phần của tinh bột cũng khác nhau:
Sơ đồ phân nhánh Amylopectin
a) Enzym b cắt xen kẽ những dây nối α-(1->4)-glucosid của amylose để tạo thành các đường maltose, kết quả thu được là 100% đường maltose. Đối với amylopectin thì b-amylase chỉ cắt được các dây nối (1->4), khi gặp mạch nhánh thì dừng lại, kết quả tạo thành maltose và dextrin, lượng maltose chỉ đạt từ 50-60%.
b) Enzym a cắt một cách ngẫu nhiên vào dây nối (1->4). Đối với amylose thì sản phẩm cuối cùng khoảng 90% là maltose ngoài ra có một ít là glucose. Đối với amylopectin thì α-amylase cũng chỉ tác động đến dây nối (1->4) mà không cắt được dây nối(1->6) vì thực tế người ta tìm thấy các phân tử isomaltose (= 6-O-α-D-gluco-pyranosyl-D-glucopyranose) trong dịch thủy phân. Enzym α-amylase tiếp tục cắt được những dextrin mà enzym b để lại để tạo thành các dextrin phân tử bé hơn. Như vậy α-amylase tác dụng lên tinh bột thì sản phẩm thu được chủ yếu là maltose rồi đến glucose và dextrin phân tử bé.
Tinh bột nguồn gốc khác nhau, enzym nguồn gốc khác nhau thì khả năng thủy phân cũng khác nhau.
Khi sự thủy phân xảy ra thì độ nhớt của dung dịch hồ tinh bột giảm dần, khả năng khử tăng lên và phản ứng với iod chuyển dần từ xanh sang tím rồi nâu hồng.
Các enzym khác: một số enzym trong nấm mốc (Aspergillus niger, Rhizopus delemar) thủy phân tinh bột rất tốt và được sử dụng ở trong quy trình kỹ nghệ để chuyển tinh bột thành glucose. Các enzym này cũng tác động lên dây nối (1->4). Một số enzym này là: amyloglucosidase, glucoamylase, g-amylase.
Enzym phosphorylase có trong đậu, khoai tây, trong lá và các bộ phận dự trữ của thực vật bậc cao. Enzym này tác dụng lên tinh bột để cho glucose-1-phosphat nhưng phải có mặt của a-amylase và enzym tách nhánh như R-enzym thì sự thủy phân mới hoàn toàn.
Một số enzym khác có khả năng tác động lên dây nối (1->6) được gọi là enzym tách nhánh ví dụ: R-enzym, isoamylase (có trong nấm men bia).
III. HÌNH DẠNG TINH BỘT.
Tinh bột tồn tại trong cây dưới dạng hạt có hình dạng và kích thước khác nhau, đây là một đặc điểm giúp ích cho việc kiểm nghiệm một dược liệu chứa tinh bột. Tùy theo loài cây và tùy theo độ trưởng thành của cây mà hình dáng và kích thước thay đổi. Về hình dáng thì có thể hình cầu, hình trứng, hình nhiều góc … kích thước có thể từ 1-100mm đường kính. Soi kính hiển vi thường thấy hạt tinh bột cấu tạo bởi nhiều lớp đồng tâm sắp xếp chung quanh một điểm gọi là rốn hạt. Các lớp này tạo nên là do hạt tinh bột lớn dần bằng cách tăng thêm các lớp ở phía ngoài. Các lớp này khác nhau ở chỉ số chiết quang và hàm lượng nước. Có tác giả cho rằng các lớp khác nhau đó là do những lớp được tăng thêm về ban đêm và những lớp tăng thêm về ban ngày nên không hoàn toàn giống nhau.
Soi kính hiển vi phân cực, hạt tinh bột có hình chữ nhật thập đen.
Trong nước lạnh hình dạng tinh bột không thay đổi. Khi nâng dần nhiệt độ thì tinh bột chuyển qua 3 giai đoạn. Giai đoạn đầu tinh bột ngậm một ít nước, nếu làm mất nước thì tinh bột trở lại tình trạng ban đầu. Khi nâng dần nhiệt độ khoảng 60-85oC thì hạt tinh bột nở ra nhanh chóng, tinh bột ngậm nhiều phân tử nước hơn, các dây nối hydro bị đứt. hạt tinh bột không thể trở lại tình trạng ban đầu. Nếu nâng cao nhiệt độ hơn nữa thì tinh bột chuyển thành hồ tinh bột. Hình (a) và (b) biểu diễn tình trạng tinh bột ở dạng không nở và dạng nở.
Sơ đồ hồ hóa tinh bột
Các loại hạt tinh bột hay gặp
Hạt hình trứng và hình thận: Tinh bột khoai tây chế từ củ cây khoai tây – Solanum tuberosum L. , thuộc họ Cà – Solanaceae. Hạt tinh bột hình trứng, rốn hạt ở đầu hẹp, các vân đồng tâm dễ nhận. Thỉnh thoảng có hạt kép 2 hoặc 3. Kích thước trung bình 50mm nhưng có hạt lớn đến 80-100mm.
Tinh bột hoàng tinh chế từ củ cây dong – Maranta arundinacea L. , thuộc họ dong – Marantaceae, (đừng nhầm với cây hoàng tinh – Polygonatum sp.). Hạt hình trứng kích thước 30-60mm.
Tinh bột sen, chế từ hạt cây sen – Nelumbo nucifera Gaertn., họ Sen – Nelumbonaceae. Hạt tinh bột hình trứng hay hình thận, rốn hạt hình vạch kích thước hạt từ 3-25mm.
Tinh bột sắn (= khoai mì) chế từ cây sắn (= khoai mì) – Manihot esculenta Crantz; họ Thầu Dầu- Euphorbiaceae. Hạt hình cầu phần lớn một đầu bị lẹm và hơi lõm trông như cái chuông. Rốn hạt hình sao, kích thước 3-35mm.
Tinh bột đậu, chế từ hạt của nhiều loại đậu – Phaseolus spp.; họ Đậu – Fabaceae. Hạt hình trứng hay hình thận. Rốn hạt dài và phân nhánh, kích thước trung bình 35mm.
Tinh bột hoài sơn, chế từ củ của cây củ mài – Dioscorea persimilis Prain và Burkill, họ Củ nâu – Dioscoreaceae. Hạt hình trứng hay hình thận. Rốn hạt dài, kích thước trung bình 40mm.
Hạt hình đĩa hay hình thấu kính dẹt: Tinh bột mì chế từ hạt của cây lúa mì – Triticum vulgare L., họ Lúa – Poaceae, kích thước hạt lớn đến 30mm, hạt bé 6-7mm. Tùy theo vị trí nhìn mà thấy hình tròn hoặc hình thấu kính lồi 2 mặt. Rốn hạt là 1 điểm ở giữa hạt, không rõ.
Hạt hình nhiều góc: Tinh bột gạo chế từ hạt cây lúa – Oriza sativa L., họ Lúa – Poaceae. Hạt nhiều góc, nhỏ, kích thước từ 4-6mm, thường được kết thành đám. Rốn hạt không rõ.
Tinh bột ngô (= bắp), chế từ hạt cây ngô – Zea mays L. ; họ Lúa – Poaceae. Hạt nhiều góc, rốn hạt ở giữa rất rõ, kích thước 15-30mm.
IV. CHẾ TINH BỘT
Chúng ta cần phân biệt bột với tinh bột. Bột mì, bột gạo khác tinh bột mì, tinh bột gạo. Muốn có bột mì chỉ cần nghiền nhỏ hạt lúa mì sau khi đã loại vỏ, nhưng muốn có tinh bột mì thì phải chế biến. Thành phần của bột mì thì ngoài glucid còn có protein, lipid, muối khoáng, vitamin … còn tinh bột mì thì thành phần chủ yếu là glucid. Nguyên tắc chung để chế tinh bột gồm có các giai đoạn: 1) Làm nhỏ nguyên liệu để giải phóng hạt tinh bột ra khỏi các tế bào, 2) nhào với nước và lọc qua rây hoặc qua vải, lấy phần dưới rây, 3) cho lên men, 4) rửa nước rồi phơi khô.
Chế tinh bột mì. Muốn có tinh bột mì thì nhào bột mì dưới một dòng nước, nước cuốn tinh bột đi để lại gluten là một khối nhão, dính tức là phần protein. Hứng nước vào thùng, tinh bột lắng xuống và còn lẫn một ít gluten. Người ta cho lên men để phân hủy gluten bằng cách trộn với 1 ít nước cũ. Sau khi lên men gạn bỏ lớp nước bên trên, rửa thêm 1 vài lần bằng nước mới rồi đem sấy hoặc phơi khô.
Chế tinh bột gạo. Ngâm gạo hay tấm với nước vôi trong 7 ngày, vớt gạo ra cho ráo nước rồi đem xay, trong lúc xay có thêm nước. Nước bột xay phải đem lọc 2 lần, lần đầu qua rây thưa, lần sau qua rây mắt mau hơn. Tinh bột qua rây còn lẫn một ít protein, cần ngâm thêm với nước vôi rồi sau đó rửa bằng nước lã, gạn lấy tinh bột rồi phơi khô.
V. ĐỊNH TÍNH VÀ ĐỊNH LƯỢNG
Để định tính tinh bột chỉ cần cho tác dụng với dung dịch iod trong nước, tinh bột sẽ có màu xanh tím, có thể định tính thẳng trên vi phẫu để xác định các tổ chức chứa tinh bột. Đây là phản ứng đặc trưng. Ngược lại có thể dùng dung dịch hồ tinh bột để phát hiện iod với nồng độ 2 x 10–6. Sự có mặt của cồn, tanin, acid nitric, chlor sẽ cản trở phản ứng.
Định lượng bằng phương pháp thủy phân acid.
Thủy phân trực tiếp: :Nguyên liệu (2,5-3g) được rửa kỹ bằng nước cất nguội, sau đó thủy phân trong vài giờ bằng 200ml H2O và 20ml HCl. Làm nguội và trung tính bằng NaOH. Thêm nước đến một thể tích xác định, lấy một phần chính xác rồi định lượng glucose tạo thành và suy ra lượng tinh bột. (Khối lượng glucose thu được x 0,9 = khối lượng tinh bột). Phương pháp này chỉ ứng dụng cho những nguyên liệu chứa chủ yếu là tinh bột vì các pentosan, galactan và một số polysaccharid khác cũng bị thủy phân cùng với tinh bột và cho sai số lớn.
Thủy phân bằng enzym rồi tiếp theo bằng acid: Nguyên tắc của phương pháp là dùng dịch chiết mạch nha (chứa các enzym thủy phân tinh bột) cho tác dụng lên nguyên liệu để chuyển tinh bột thành đường hòa tan (maltose và một số đường khác), sau đó dùng acid để thủy phân tiếp. Glucose tạo thành sẽ được định lượng bằng
một trong những phương pháp đã được chấp nhận.
Phương pháp dựa trên cơ sở của Purse: Phương pháp này hiện nay dùng để định lượng tinh bột trong nguyên liệu thực vật bao gồm các giai đoạn: loại đường bằng ethanol, hòa tan tinh bột bằng acid perchloric loãng và nguội, tách tinh bột dưới dạng phức tinh bột – iod không tan, phân hủy phức rồi thủy phân tinh bột thành glucose và định lượng glucose bằng phương pháp tạo màu với anthron (màu xanh) hoặc bằng các phương pháp khác.
Phương pháp không thủy phân để định lượng tinh bột.
Phương pháp dùng phân cực kế: Trong phương pháp này người ta dùng dung dịch calci chlorid đặc và nóng để hòa tan tinh bột, sau đó là định lượng bằng cách đo độ quay cực, [α]20D của dung dịch tinh bột là +200.
Phương pháp tạo phức với iod: khi cho dung dịch tinh bột tác dụng với iod thì tạo phức có màu, có thể dùng để định lượng. Người ta dùng acid perchloric để hòa tan tinh bột rối cho tác dụng với iod, đo màu so sánh với mẫu tinh bột tinh chế. Trong phương pháp này không cần thiết phải loại đường.
Kiểm tra chất lượng
Dược điển Việt Nam IV quy định kiểm tra tạp chất lạ, kim loại nặng, arsenic, giới hạn acid.
VI. CÔNG DỤNG
Tinh bột là thành phần chính trong lương thực. Nguyên liệu có nhiều tinh bột là các hạt ngũ cốc, các loại củ như khoai, sắn (khoai mì), củ mài, củ đao (Canna edulis Ker. Gawl., họ Chuối hoa- Cannaceae). Có khi bộ phận dự trữ lại là thân cây ví dụ cây báng (Arenga pinnata Merr., họ Cau – Arecaceae).
Hiện nay nguồn để chế tinh bột dùng trong nước và xuất khẩu quan trọng nhất là sắn – Manihot esculenta Crantz. Giá trị xuất khẩu của 1 tấn tinh bột sắn là 200 USD và cứ 3,5 tấn sắn tươi thì cho 1 tấn tinh bột. Năm 1995 tỉnh Tây Ninh đã xuất được 28000 tấn tinh bột sắn.
Trong ngành dược tinh bột được dùng làm tá dược viên nén. Để cho dễ tiêu hóa người ta có thể chế loại tinh bột đã được rang lên, tinh bột đã thủy phân 1 phần. Nhà máy thực phẩm Linh Xuân (TP.HCM) đã sản xuất maltodextrin dùng để cho vào sữa bột Dielac. Tinh bột còn là nguyên liệu để sản xuất glucose, cồn ethylic, monosodium glutamat, bánh kẹo…
https://hoibacsy.vn
TÀI LIỆU THAM KHẢO
Ngô Văn Thu (2011), “Bài giảng dược liệu”, tập I. Trường đại học Dược Hà Nội
Phạm Thanh Kỳ (1998), “Bài giảng dược liệu”, tập II. Trường đại học Dược Hà Nội
Đỗ Tất Lợi (2004), “Những cây thuốc và vị thuốc Việt Nam”, Nhà xuất bản Y học
Viện dược liệu (2004), “Cây thuốc và động vật làm thuốc ở Việt Nam”, tập I, Nhà xuất bản khoa hoc kỹ thuật.
Viện Dược liệu (2004), “Cây thuốc và động vật làm thuốc Việt Nam”, tập II, Nhà xuất bản Khoa học kỹ thuật