Đồng nhiễm HIV và HCV
Dịch tễ học và đường lây truyền
Đồng nhiễm HIV và HCV xảy ra thường xuyên do 2 loại virus có cùng một đường lây truyền (đường máu, tình dục và truyền dọc). Ở Mỹ có khoảng 240.000 người (30% số người nhiễm HIV) nhiễm cả 2 virus.
Một số nước châu Âu thậm chí còn có tỷ lệ đồng nhiễm cao hơn. Ở Tây Ban Nha, ít nhất 50% trong số 130.000 bệnh nhân HIV cũng nhiễm HCV do tỷ lệ người tiêm chích ở đây rất cao. Trên 90% số bệnh nhân đồng nhiễm có HCV RNA dương tính, tức là viêm gan C mạn tính.
Do khả năng lây qua đường máu của HCV cao hơn HIV tới 10 lần, người tiêm chích ma túy và người được truyền chế phẩm máu là những người dễ nhiễm nhất. Khả năng nhiễm HCV sau khi bị kim đâm là 2-8%, trong khi với HIV chỉ 0,3%.
Ngược lại, HCV ít lây qua đường tình dục hơn so với HBV hoặc HIV. Do đó, HCV rất hiếm ở nam giới đồng tính luyến ái và đồng nhiễm cũng hiếm hơn ở nhóm này. Tuy nhiên gần đây đã có các chuỗi ca viêm gan C cấp được thông báo trong số các bệnh nhân nam đồng tính luyến ái nhiễm HIV, chứng tỏ HCV có thể lây qua đường tình dục. Nguy cơ nhiễm phụ thuộc số bạn tình và hình thức quan hệ tình dục hay gây tổn thương (Vogel 2005). Tổng số có khoảng 4-8% số nam giới đồng tính luyến ái nhiễm HIV cũng nhiễm HCV.
Sự lây truyền HCV từ mẹ sang con rất hiếm ở những người không suy giảm miễn dịch (< 1%). Tỷ lệ lây truyền tăng lên cùng với mức suy giảm miễn dịch ở các bà mẹ nhiễm HIV và được ước tính tới 20%. Mặt khác, nguy cơ lây truyền mẹ-con của HCV không tăng ở các bà mẹ nhiễm HIV được điều trị hiệu quả bằng HAART (trị liệu kháng retrovirus hiệu lực cao) (< 3% khi kết hợp với mổ lấy thai; Pembreya 2005).
Diễn biến lâm sàng và bệnh sinh
Diễn biến của viêm gan C ở bệnh nhân đồng nhiễm HIV/HCV
Diễn biến lâm sàng của viêm gan C khi đồng nhiễm HIV phụ thuộc vào mức độ suy giảm miễn dịch của HIV. Suy giảm miễn dịch càng nhanh thúc đẩy quá trình tiến triển nặng của viêm gan C. Thời gian tiến triển tới suy gan hay ung thư gan là khoảng 10-20 năm, trong khi ở bệnh nhân nhiễm HCV đơn thuần, thời gian tiến triển đến suy gan hoặc ung thư gan tới 30- 40 năm.
Những tiến bộ trong điều trị HIV đã tăng thời gian sống của bệnh nhân do đó có thể đủ thời gian để diến tiến tới suy gan. Tỷ lệ tử vong do HIV giảm đã làm tăng tương đối biến chứng do viêm gan. Ở một số trung tâm, suy gan đã trở thành nguyên nhân tử vong hàng đầu ở bệnh nhân HIV.
Ngược lại, hiện chưa thấy ảnh hưởng rõ rệt của viêm gan C tới diễn biến của nhiễm HIV (Rockstroh 2005).
Diễn biến không thuận lợi của viêm gan C ở bệnh nhân HIV có thể được cải thiện nhờ HAART. Ngoài ra, có thể làm chậm quá trình tiến triển tới suy gan khi chức năng miễn dịch được cải thiện nhờ HAART. Điều này rất đúng ở những bệnh nhân đạt được phục hồi miễn dịch tốt.
Ngoài ra, viêm gan C có thể làm trầm trọng độc tính gan của một số phác đồ HAART. Tới 10% số bệnh nhân phải dừng HAART (trị liệu kháng retrovirus hiệu lực cao) vì độc tính gan nặng. Nguy cơ này có liên quan đặc biệt tới các “d-nucleoside” (ddI, ddC, d4T). Các thuốc này nên tránh ở những bệnh nhân đồng nhiễm. Nevirapine và tipranavir cũng cần được dùng một cách cẩn trọng.
Ở một số bệnh nhân đồng nhiễm, tăng transaminase tạm thời thường xuất hiện sau khi bắt đầu điều trị HAART. Hiện tượng này tương ứng với phản ứng viêm của viêm gan C do tình trạng miễn dịch được cải thiện. Tuy nhiên, theo dõi lâu dài thấy HAART (trị liệu kháng retrovirus hiệu lực cao) cải thiện diễn biến của viêm gan C. Chỉ định điều trị HAART (trị liệu kháng retrovirus hiệu lực cao) theo những hướng dẫn hiện hành cần được đánh giá cẩn thận ở mọi bệnh nhân đồng nhiễm.
Chẩn đoán
Các xét nghiệm chẩn đoán bệnh nhân đồng nhiễm cũng không khác gì so với các xét nghiệm chẩn đoán bệnh nhân nhiễm HCV đơn thuần (Bảng 1). Phát hiện kháng thể HCV (anti-HCV) chứng tỏ có phơi nhiễm với virus nhưng không phân biệt được viêm gan đã khỏi hay viêm gan C mạn tính. Viêm gan C mạn tính được chẩn đoán bằng virus huyết (nghĩa là HCV RNA trong máu). Cần lưu ý là kháng thể HCV có thể mất đi trong tiến trình nhiễm HIV do suy giảm miễn dịch, tuy vậy hiện tượng này ngày nay đã hiếm dần, có lẽ do các xét nghiệm đã tốt hơn. Do đó, cần xác định lượng HCV RNA trong máu, ngay cả khi anti-HCV âm tính, nếu có nghi ngờ về lâm sàng hoặc suy giảm miễn dịch nặng. Tương tự như vậy, định lượng HCV RNA được chỉ định trong trường hợp nghi ngờ viêm gan C cấp do kháng thể HCV chỉ xuất hiện sau nhiễm virus từ 1-5 tháng.
Bệnh nhân đồng nhiễm HIV/HCV có lượng HCV trong máu cao hơn so với bệnh nhân HCV đơn thuần (khoảng 1 log). Tuy nhiên, lượng virus trong máu không có giá trị tiên lượng diễn biến của viêm gan C. Do đó, việc xét nghiệm HCV-RNA thường xuyên là không cần thiết. Cũng cần lưu ý rằng một số bệnh nhân có thể mất HCV RNA song song với sự tiến triển của suy giảm miễn dịch, nhưng lại bị đợt bùng phát của viêm gan C cùng với các triệu chứng của phục hồi miễn dịch do HAART (trị liệu kháng retrovirus hiệu lực cao) (Kim 2006). Vì vậy, xét nghiệm thường xuyên quanh thời điểm bắt đầu HAART (trị liệu kháng retrovirus hiệu lực cao) là có ích. Ngoài thời điểm đó, chúng tôi cho rằng xét nghiệm HCV RNA mỗi năm 1 lần là đủ. Có thể dự đoán đáp ứng điều trị dựa vào tải lượng HCV: nếu lượng HCV RNA dưới 800.000 IU/ml, khả năng thành công cao hơn khi lượng virus trên 800.000 IU/ml (800.000 IU/ml tương đương 2 triệu bản sao/ml tùy loại xét nghiệm được sử dụng).
Đáp ứng điều trị còn phụ thuộc kiểu gen của virus. Có 6 kiểu gen của virus với nhiều subtype, và chúng có đặc điểm phân bố địa lý khác nhau: kiểu gen 1 và 3 chủ yếu ở châu Âu, kiểu gen 4 và 5 ở châu Phi và kiểu gen 6 ở châu Á. Các kiểu gen 2 và 3 có đáp ứng tốt hơn với interferon. Có khả năng nhiễm nhiều kiểu gen. Trước khi bắt đầu điều trị nên xác định kiểu gen virus mà bệnh nhân nhiễm.
Đánh giá độ xơ gan là rất cần thiết để ước tính mức độ phá hủy gan. Trong các thủ thuật không xâm nhập thì Fibroscan đang được lưu tâm đặc biệt. Kỹ thuật này (đo độ đàn hồi) xác định mức độ cứng của gan và lập tương quan với mức độ xơ hóa. Do các kỹ thuật không xâm nhập mà vai trò của sinh thiết gan trước điều trị HCV phải được xác định lại. Việc theo dõi bằng sinh thiết gan khi chưa điều trị cũng không cần thiết nữa. Nếu không sinh thiết gan, các khuyến cáo gần đây đều khuyên điều trị viêm gan trong trường hợp kiểu gen 2+3, hoặc kiểu gen 1 và lượng HCV trong máu thấp. Nếu có sinh thiết gan và không thấy có tổn thương xơ rõ rệt, không nhất thiết phải điều trị ngay cho dù kiểu gen là gì.
Đã có một số phân loại về mô học đã được đưa ra. Ở châu Âu, bảng điểm METAVIR được dùng nhiều nhất. Bảng điểm này chia 5 giai đoạn xơ gan (0=không xơ, 1= xơ khoảng cửa nhưng chưa có vách, 2= có 1 số vách, 3= vách rõ rệt nhưng chưa xơ nặng, 4= xơ gan rõ).
Mức độ viêm gan được chia theo độ nặng của tổn thương viêm hoại tử (A0= không có, A1= nhẹ, A3= trung bình, A4= mạnh). Điều trị được khuyến cáo cho các độ F2-F4; có thể trì hoãn ở các độ F0+F1.
Nếu có các chỉ điểm về lâm sàng khiến phải loại trừ hay khẳng định các biểu hiện ngoài gan (viêm mạch, viêm cầu thận, albumin tủa lạnh), cần phải làm các xét nghiệm cần thiết (sinh thiết da, xét nghiệm nước tiểu, sinh thiết thận, phát hiện cryoglobulin trong huyết thanh).
Các khuyến cáo về xét nghiệm tự kháng thể để loại trừ bệnh tự miễn cũng không thống nhất và kết quả xét nghiệm cũng khó phiên giải: tới 60% số bệnh nhân viêm gan C có tự kháng thể như ANA, RF, anticardiolipin, SMA và LKM1, đó là hiện tượng tự miễn đi kèm với bệnh mà không có ý nghĩa lâm sàng. Nếu nồng độ các tự kháng thể đó tăng hoặc xuất hiện lần đầu trong quá trình điều trị interferon, không cần thiết phải ngừng điều trị, và do đó, khuyến cáo xét nghiệm tự kháng thể một cách thường quy vẫn còn đang được tranh cãi. Để loại trừ viêm gan tự miễn, các kháng thể ANA, SMA, ANCA và LKM1 cần được xét nghiệm trước điều trị interferon. Các bệnh nhân có kết quả dương tính cần được theo dõi chặt để phát hiện sự tồi đi của chức năng gan khi điều trị interferon vì đó là biểu hiện của viêm gan tự miễn hoạt động. Nếu chức năng gan tồi đi, cần ngừng interferon. Điều trị ức chế miễn dịch được quyết định cho từng ca bệnh riêng biệt.
Trước khi điều trị interferon, cần xác định nồng độ TSH để loại trừ bệnh lý tuyến giáp. Nếu chức năng tuyến giáp bình thường, có thể theo dõi TSH mỗi 12 tuần. Nếu có biểu hiện suy giáp, điều trị thay thế bằng levothyroxin và nếu có cường giáp, có thể sử dụng các điều trị bình giáp trước khi điều trị interferon. Sau khi đã điều trị ổn định, có thể điều trị interferon với sự theo dõi chặt TSH (mỗi 4 tuần). Khoảng 5% bệnh nhân bị rối loạn chức năng tuyến giáp khi điều trị interferon. Hiện tượng này thường xuất hiện trong vòng 3 tháng đầu điều trị. Nếu có biểu hiện suy giáp xảy ra, có thể tiếp tục interferon kèm theo điều trị levothyroxine. Nhưng nếu có biểu hiện cường giáp, đa số các tác giả ngừng điều trị, mặc dù vẫn có thể tiếp tục điều trị interferon trong 1 số ca cụ thể. Trong đa số các bệnh nhân, chức năng giáp trở về bình thường sau khi ngừng interferon. Tuy nhiên cũng có những ca rối loạn chức năng giáp kéo dài và vấn đề điều trị là tùy từng bệnh nhân cụ thể.
Tới 12% số bệnh nhân viêm gan C có tự kháng thể kháng giáp trước khi điều trị interferon (kháng thể kháng peroxidase giáp = anti-TPO, kháng thể kháng thyroglobulin và kháng thể kháng thụ thể TSH). Ở những bệnh nhân này, nguy cơ rối loạn chức năng tuyến giáp nặng khi điều trị interferon là cao hơn ở bệnh nhân không có các kháng thể đó. Nếu có thể thì cần xác định các tự kháng thể trước khi điều trị cho mọi bệnh nhân, nhưng ít nhất thì cũng ở những bệnh nhân có TSH bất thường để có các giá trị ban đầu dùng cho theo dõi bệnh nhân sau này.
Nếu không điều trị thì cần định lượng alpha-fetoprotein (AFP) và siêu âm gan mỗi 6-12 tháng để phát hiện sớm ung thư tế bào gan (HCC). Điều này đặc biệt quan trọng cho bệnh nhân độ xơ gan F3/F4. Do diễn biến của viêm gan C bị đẩy nhanh khi đồng nhiễm HIV và 10-30% bệnh nhân sẽ bị ung thư mà không xơ gan, việc sàng lọc thường quy cần được áp dụng cho mọi bệnh nhân. Một số chuyên gia thậm chí còn khuyến cáo thời gian sàng lọc ngắn hơn tuy nhiên không phải ở đâu cũng áp dụng được.
Bảng 1: Các quy trình chẩn đoán viêm gan C ở bệnh nhân đồng nhiễm HIV
| Chẩn đoán viêm gan C |
| HCV-Ab (dương tính 1-5 tháng sau nhiễm virus, có thể mất nếu suy giảm miễn dịch) |
| HCV-RNA (không tiên lượng được diễn biến nhưng giúp đánh giá đáp ứng điều trị) |
| Tình trạng tổn thương gan |
| Đánh giá mức độ xơ hóa (Fibroscan, sinh thiết gan) |
| Các chỉ số chức năng tổng hợp của gan (đông máu, protein, albumin, CHE) |
| Siêu âm và AFP mỗi 6 tháng |
| Trước điều trị |
| HCV genotype |
| Tự kháng thể (ANA, SMA, ANCA and LKM1) |
| TSH, tự kháng thể giáp (nếu được) |
| Theo dõi điều trị |
| Công thức máu và men gan mỗi 2-4 tuần |
| HCV-RNA mỗi 12 tuần (và tuần 4 để đánh giá đáp ứng virus sớm) |
| CD4 mỗi 12 tuần |
| TSH mỗi 12 tuần |
Điều trị
Lý do quan trọng nhất để điều trị viêm gan C là diễn biến bất lợi của bệnh khi đồng nhiễm HIV, tăng thời gian sống nhờ HAART, tăng tử vong do bệnh gan, và tăng nguy cơ độc tính gan của HAART. Ngoài ra, điều trị thành công viêm gan C cũng cải thiện thời gian sống sót.
Mục tiêu của điều trị viêm gan C là đạt HCV RNA âm tính kéo dài. Người ta thường gọi đó là đáp ứng bền vững, với định nghĩa là HCV RNA âm tính kéo dài 6 tháng sau khi hoàn thành điều trị.
HCV RNA âm tính tại thời điểm kết thúc điều trị chỉ là “đáp ứng lúc kết thúc điều trị”. Nếu transaminase về bình thường thì gọi là đáp ứng sinh hóa. Tuy nhiên, đáp ứng này không tương đồng với diễn biến lâm sàng của viêm gan C và không còn được sử dụng nữa. Không đáp ứng điều trị được gọi là “không đáp ứng”.
Trong những phần dưới đây, tỷ lệ đáp ứng điều trị luôn được hiểu là đáp ứng kéo bền vững. Chỉ có đáp ứng bền vững mới đảm bảo giải quyết được quá trình xơ hóa của gan và các biểu hiện ngoài gan, cũng như đảm bảo ngăn ngừa được lây truyền.
Nếu HCV RNA lại xuất hiện sau khi đã âm tính thì gọi là tái phát. Nguy cơ tái phát cao nhất trong vòng vài tháng đầu sau khi hoàn thành điều trị rồi giảm dần sau đó. Vì thế, thành công của điều trị được xác định và đánh giá sau 6 tháng kể từ khi hoàn thành liệu trình. Trong một số ca cụ thể, tái phát có thể xuất hiện muộn hơn, có thể sau hàng năm. Do đó, theo dõi định kỳ là rất cần thiết, kể cả khi đã điều trị thành công (theo dõi men gan, HCV RNA nếu nghi ngờ tái phát).
Phối hợp PEG interferon và ribavirin được coi là phác đồ tiêu chuẩn cho các bệnh nhân đồng nhiễm. Tỷ lệ đáp ứng tới 50% đã có thể đạt được (Torriani 2004, Nuñez 2006). Các kiểu gen 2 và 3 có tỷ lệ đáp ứng cao hơn (80%) so với kiểu gen 1 và 4 (40%). Thời gian điều trị được điều chỉnh cho từng bệnh nhân và phụ thuộc vào kiểu gen và đáp ứng điều trị ban đầu. Tuy nhiên, những bệnh nhân kiểu gen 1 và 4 có thể thu được ích lợi với liệu trình điều trị dài hơn (Nuñez 2006). Ngược lại, ở một số bệnh nhân kiểu gen 2 và 3, nếu họ đáp ứng nhanh với điều trị (HCV RNA âm tính sau 4 tuần) thì có thể xem xét liệu trình điều trị ngắn hơn.
Ghép gan là lựa chọn cho bệnh nhân xơ gan mà không thể điều trị bằng interferon.
Mối lo ngại về tác động xấu của interferon lên bệnh lý nhiễm HIV chưa được khẳng định trong bất cứ nghiên cứu nào. Trên thực tế, người ta thấy có tác động ức chế virus ở đa số các bệnh nhân do tác dụng kháng virus của interferon. Số CD4 có thể giảm nhẹ do giảm bạch cầu tạm thời, nhưng tỷ lệ % thì thường tăng. Chưa có nghiên cứu nào đưa ra kết quả bệnh lý HIV diễn biến nặng hơn (Soriano 2002).
Vẫn chưa có phác đồ điều trị phù hợp cho các bệnh nhân không đáp ứng hoặc tái phát. Ở những bệnh nhân được điều trị từ trước bằng interferon đơn thuần, có thể thử điều trị phối hợp PEG-interferon và ribavirin. Hiện chưa có khuyến cáo điều trị nào cho bệnh nhân thất bại với phác đồ chứa PEG-interferon. Một số bệnh nhân vẫn đáp ứng nếu tái trị, đặc biệt khi tuân thủ kém hoặc tác dụng phụ chưa được xử trí đầy đủ trong lần điều trị ban đầu. Ở một số bệnh nhân, phối hợp PEG-interferon, ribavirin và amantidine (2 x 100 mg/ngày) đã thành công, mặc dù chưa có các dữ liệu đáng tin cậy. Các thuốc ức chế protease và polymerase của HCV cũng như các thuốc khác sẽ được đưa ra trong các năm tới.
Các lời khuyên khi theo dõi điều trị
Các khuyến cáo sau có thể áp dụng cho bệnh nhân HIV đồng nhiễm:
Chỉ định và chống chỉ định
Do đồng nhiễm HIV làm tăng tiến triển của viêm gan C và tăng nguy cơ độc tính khi điều trị HAART, chỉ định điều trị cần được quyết định ở mỗi bệnh nhân được chẩn đoán đồng nhiễm HIV/HCV.
Đặc biệt, điều trị cần được thảo luận ở những ca có kết quả sinh thiết khẳng định xơ độ F2- F4. Các biểu hiện ngoài gan của viêm gan C cũng là chỉ định điều trị (viêm mạch, viêm cầu thận, cryoglobulin hệ thống). Các yếu tố sau có tiên lượng điều trị tốt hơn:
- HCV RNA < 800,000 IU/ml (+ kiểu gen 1)
- HCV kiểu gen 2+3
- Tuổi < 50
- Mức độ xơ hóa thấp trên mô học hoặc bằng phương pháp không xâm nhập
- γ-GT bình thường
- Nhiễm HIV ổn định
Cũng cần đánh giá các chống chỉ định. Các chống chỉ định quan trọng nhất bao gồm:
- Xơ gan mất bù hoặc tiền sử xơ gan mất bù (không phải xơ gan còn bù hay xơ gan độ Child A)
- Giảm bạch cầu (<1,500/µl)
- Giảm tiểu cầu (< 50,000/µl)
- Thiếu máu (< 10 g/dl)
- Rối loạn chức năng tuyến giáp mức độ nặng chưa được điều trị
- CD4 < 200/µl (chống chỉ định tương đối, xem dưới)
- Các bệnh tâm thần nặng
- Bệnh tim có triệu chứng
- Nhiễm trùng cơ hội cấp tính
- Đang nghiện rượu hoặc ma túy
- Đang điều trị HIV bằng ddI (cũng nên tránh cả AZT và d4T)
Điều trị thay thế methadone hay polamidone không phải là một chống chỉ định nếu được theo dõi kỹ trong quá trình điều trị. Tuy nhiên, bệnh nhân đang nghiện ma túy hoặc rượu cần được đưa đến các chương trình điều trị phù hợp.
Khi nào điều trị
Nếu quyết định điều trị HCV, cần lưu ý tới tình trạng miễn dịch và phác đồ bệnh nhân đang sử dụng. Một số kế hoạch sau có thể áp dụng:
Bệnh nhân không điều trị HAART
Nếu có thể, nên điều trị HCV trước khi điều trị HIV. Lý do là tránh độc tính gan khi điều trị HAART (trị liệu kháng retrovirus hiệu lực cao) ở bệnh nhân đồng nhiễm, giảm tác động hạn chế phục hồi miễn dịch của viêm gan C, tuân thủ tốt hơn và tránh tương tác thuốc.
Nếu CD4 trên 350/µl, có thể bắt đầu điều trị viêm gan C. Còn chưa rõ liệu tải lượng virus cao (> 50,000/ml) có cần thiết phải điều trị HAART (trị liệu kháng retrovirus hiệu lực cao) hay không.
Nếu CD4 trong khoảng từ 200 đến 350/µl, có thể điều trị viêm gan C nếu HIV RNA dưới 5000 bản sao/ml. Nếu tải lượng cao hơn, cân nhắc điều trị HAART.
CD4 dưới 200/µl là chống chỉ định tương đối. Cần điều trị HAART (trị liệu kháng retrovirus hiệu lực cao) trước. Khi CD4 tăng tốt, có thể cân nhắc điều trị interferon.
Bệnh nhân đang điều trị HAART
Khi CD4 trên 350/µl và bệnh nhân đang điều trị HAART (trị liệu kháng retrovirus hiệu lực cao) ổn định, VL dưới ngưỡng phát hiện, có thể điều trị viêm gan.
Nếu CD4 trong khoảng từ 200 đến 350/µl và VL duy trì ổn định dưới ngưỡng phát hiện, quyết định điều trị hay không phụ thuộc toàn trạng (cân nhắc mức độ nặng của viêm gan, kiểu gen của HCV và tình trạng HIV).
CD4 dưới 200/µl là chống chỉ định tương đối. Vấn đề là cân nhắc nguy cơ khi điều trị interferon (đáp ứng có thể kém hơn và làm giảm CD4 do tác động của interferon).
Nếu cần thiết, thay đổi phác đồ ARV vài tuần trước khi bắt đầu điều trị viêm gan C. ddI bị chống chỉ định khi điều trị viêm gan C (do dẫn tới viêm tụy, độc tính ty thể và mất bù của gan). AZT và d4T cũng cần tránh để giảm độc tính (AZT: thiếu máu và giảm bạch cầu, d4T: độc ty thể). Trước khi thay đổi HAART, cần đảm bảo duy trì thành công của điều trị HIV. Trong các ca này, chỉ nên điều trị HCV nếu toàn trạng ổn định, tức là ức chế tốt virus, và các tác dụng phụ đã được điều trị.
Thực hành điều trị
Phối hợp PEG-interferon và ribavirin trong 48 tuần là phác đồ tiêu chuẩn (Rockstroh 2004, Alberti 2005). Tuy nhiên, độ dài tiêu chuẩn 48 tuần phải được cân chỉnh tùy theo kiểu gen và tốc độ đáp ứng virus (Soriano 2007).
Có 2 loại PEG-interferon hiện đang lưu hành: PEG-Intron™ và Pegasys™. PEG-Intron™ được tiêm dưới da theo liều 1.5 µg/kg. Pegasys™ được tiêm dưới da theo liều cố định 180 µg. Cả 2 thuốc đều được tiêm một lần mỗi tuần và cần được bảo quản lạnh.
Liều ribavirin phụ thuộc cân nặng: bệnh nhân dưới 75 kg cần liều 1000 mg/ngày, bệnh nhân trên 75 kg cần liều 1200 mg/ngày bất kể kiểu gen gì. Các viên thuốc có thể được uống 1 lần trong ngày hoặc chia ra nhiều lần trong ngày.
Mọi bệnh nhân cần được theo dõi định kỳ. Lúc đầu cần theo dõi mỗi 2 tuần, sau đó ít nhất mỗi 4 tuần. Các xét nghiệm cần theo dõi là (xem Bảng 1):
- Công thức máu và transaminase mỗi 2-4 tuần
- Chức năng tuyến giáp mỗi 12 tuần (thường xuyên hơn nếu có rối loạn chức năng từ trước).
- Tình trạng miễn dịch mỗi 12 tuần
- Nồng độ lactate mỗi 4 tuần ở bệnh nhân uống đồng thời d4T
HCV RNA là chỉ số quan trọng nhất giúp đánh giá đáp ứng điều trị và cần được đo sau 4, 12 và 24 tuần để quyết định độ dài thời gian điều trị.
Thời gian điều trị phụ thuộc đáp ứng của từng người (xem Hình 1). Nếu có đáp ứng sớm (HCV RNA âm tính sau 4 tuần), có thể điều trị ngắn hơn với kiểu gen 2 và 3 (ở bệnh nhân tải lượng virus ban đầu thấp và xơ gan không đáng kể). Trong mọi trường hợp khác nếu tải lượng virus không giảm ít nhất 2 log sau 12 tuần, cần ngừng điều trị bởi sẽ không có đáp ứng (“luật ngừng 2 log”).
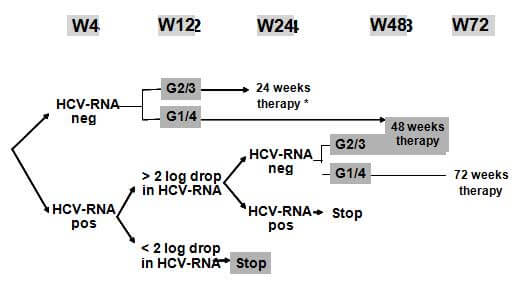
Hình 1. Quy trình điều trị viêm gan C (theo Soriano 2007)
Điều trị các tác dụng phụ
Điều trị các tác dụng phụ thường là yếu tố quyết định cho thành công của điều trị (xem Bảng 2). Tỷ lệ bỏ trị cao tới 30% ở một số nghiên cứu lâm sàng trước đây có lẽ là do thiếu kinh nghiệm khi điều trị phối hợp. Điều trị đúng các tác dụng phụ dẫn tới tỷ lệ thành công coa hơn. Nên chỉ rõ cho bệnh nhân rằng các tác dụng phụ thường phục hồi được sau khi ngừng điều trị.
Cần tư vấn kỹ về các tác dụng phụ cho bệnh nhân trước khi điều trị. Ba vấn đề chính cần lưu ý là:
Gần như mọi bệnh nhân đều có các triệu chứng kiểu cúm và mệt mỏi khi bắt đầu điều trị. Mức độ nặng của triệu chứng không thể dự đoán được, do đó điều trị cần khởi đầu vào những ngày không phải ngày nghỉ hay ngày lễ. Bác sỹ điều trị phải luôn sẵn sàng trong những ngày đầu điều trị. Ngoài ra, cần kê paracetamol (liều tùy từng người, liều duy nhất 1000 mg). Triệu chứng thường tiến bộ trong vòng 2-4 tuần đầu. Phần lớn các bệnh nhân dung nạp tốt và có thể tiếp tục các hoạt động hàng ngày của họ. Tuy nhiên, trong thời gian đầu điều trị, bệnh nhân có thể không làm việc được trong vài ngày. Trong một số ca hiếm, tác dụng phụ trầm trọng đến mức bệnh nhân không thể làm việc được trong suốt thời gian điều trị. Điều này cũng cần phải được thảo luận với bệnh nhân từ trước.
Ribavirin gây thiếu máu tan máu ở 20% bệnh nhân. Có thể điều trị tác dụng phụ này bằng epoetin alfa. Liều dùng cũng khác nhau: thường dùng khoảng 100 IE/kg cân nặng tiêm dưới da tuần 3 lần, tuy nhiên liều 40.000 IE tuần 1 lần cũng cải thiện đáng kể thiếu máu do ribavirin (Sulkowski 2005). Ngoài ra, giảm liều ribavirin một nửa (khi hemoglobin dưới 10 g/dl) hoặc ngừng ribavirin (khi hemoglobin dưới 8,5 g/dl) cũng là lựa chọn có thể áp dụng. Tuy nhiên, giảm liều chỉ nên áp dụng khi epoetin không có hiệu quả. Các nghiên cứu gần đây cho thấy sử dụng liều ribavirin hợp lý đưa đến đáp ứng điều trị tốt hơn. Liều acid folic 5 mg/ngày được khuyến cáo để giảm độc tính với hệ tạo máu.
Điều trị các yếu tố kích thích tế bào hạt (GCSF) có thể giảm bớt tác dụng hạ bạch cầu của interferon. Tuy nhiên kinh nghiệm điều trị trên lâm sàng còn hạn chế. Với thuốc này, liều interferon có thể được duy trì trong trường hợp hạ bạch cầu nặng (bạch cầu trung tính dưới 500 /µl). Liều GCSF cần dùng tùy từng bệnh nhân. Trong đa số các ca, có thể dùng liều thấp do bản thân quá trình tạo máu không bị ảnh hưởng (ví dụ Filgrastim 30 Mio IE hàng tuần).
Đánh giá tác dụng phụ tâm thần cần được tiến hành mỗi lần khám. Quan sát của những người khác, ví dụ thành viên gia đình, cũng rất có ích. Trầm cảm mức độ nhẹ khi điều trị interferon có thể điều trị bằng các thuốc chống trầm cảm dung nạp tốt (ví dụ paroxetin 20 mg/ngày).
Trong những trường hợp có tiền sử trầm cảm, có thể tính đến điều trị dự phòng bằng paroxetin. Cần ngừng điều trị ngay khi có biểu hiện trầm cảm nặng hoặc có ý tưởng tự sát.
Hiện tượng sút cân có thể điều trị bằng chế độ ăn. Cần đảm bảo duy trì chế độ ăn theo nhu cầu của bệnh nhân (ví dụ ở những bệnh nhân nghiện ma túy). Sút cân còn có thể là biểu hiện rối loạn phân bố mỡ, do đó cần chọn các dẫn chất nucleoside ít có nguy cơ gây rối loạn mỡ.
Rối loạn chức năng tuyến giáp có thể xuất hiện trong khi điều trị interferon (xem trên), nhưng không nhất thiết phải dừng điều trị. Ở phần lớn các ca bệnh, đầu tiên có biểu hiện cường giáp, sau đó có thể tiến triển thành suy giáp nếu điều trị kéo dài. Biểu hiện cường giáp rõ đến mức khiến hầu hết các bác sỹ phải ngừng điều trị. Nếu ngừng điều trị kịp thời thì tiên lượng sẽ rất tốt. Nếu tiếp tục điều trị interferon, biểu hiện suy giáp sẽ không phục hồi và sẽ cần điều trị hormone thay thế cả đời. Nếu bệnh nhân có suy giáp từ trước, có thể tiếp tục điều trị interferon cùng với điều trị bổ sung levothyroxine.
Bảng 2: Các tác dụng phụ quan trọng của PEG-interferon/Ribavirin
| Tác dụng phụ | Điều trị |
| Interferon | |
| Các triệu chứng kiểu cúm | Paracetamol |
| Giảm bạch cầu, tiểu cầu | Giảm liều IFN, G-CSF |
| Các triệu chứng tâm thần | Chống trầm cảm, ngừng IFN |
| Sút cân | Dinh dưỡng |
| Hiện tượng tự miễn | Ngừng IFN |
| Ribavirin | |
| Tan máu | Folic acid, Erythropoetin, giảm liều Ribavirin |
Các khuyến cáo điều trị luôn thay đổi. Do đó nên liên hệ các trung tâm điều trị có kinh nghiệm nếu cần tư vấn.
Do tính phức tạp của đồng nhiễm HIV/HCV, bệnh nhân nên được điều trị trong các nghiên cứu lâm sàng nếu có thể.
Viêm gan C cấp tính
Trong những năm gần đây, số lượng các ca viêm gan C cấp tính tăng liên tục ở nam giới đồng tính luyến ái. Các bệnh nhân đó đều có tiếp xúc nguy cơ cao (ví dụ dùng đồ chơi tình dục…). Do kháng thể HCV chỉ xuất hiện sau một thời gian khá dài kể từ khi nhiễm virus, chẩn đoán viêm gan C cấp đều dựa vào tiền sử, tăng men gan và HCV RNA dương tính.
Hiện chưa rõ phương pháp tốt nhất để điều trị viêm gan C cấp. Các dữ liệu có được cho tới nay đều cho thấy tỷ lệ đáp ứng có cải thiện ở mức 60% (tới 80% ở kiểu gen 2/3) nếu điều trị sớm (Vogel 2005). Các dữ liệu đó ủng hộ điều trị sớm ngay cả khi đồng nhiễm HIV. Tuy nhiên, thải loại tự nhiên sau nhiễm virus cấp có thể tốt hơn so với người ta vẫn nghĩ trước đây. Cách tiếp cận sau có lẽ là hợp lý: nếu viêm gan C cấp có triệu chứng (đặc biệt là vàng da), theo dõi bệnh nhân trong 12 tuần xem có thải loại virus tự nhiên hay không; nếu viêm gan không triệu chứng, cần điều trị ngay. Chúng tôi thường điều trị trong 24 tuần bằng peg- interferon đơn thuần nếu kiểu gen 2+3, peg-interferon phối hợp ribavirin nếu kiểu gen 1+4 Tuy nhiên, cho tới nay vẫn chưa biết chiến lược tối ưu là gì. Nếu được thì mời bệnh nhân tham gia các nghiên cứu lâm sàng.
