CÔNG NGHỆ ANTISENSE
Trị liệu antisense được thiết kế để chuyển các phân tử antisense tới các TB đích, các phân tử này sẽ lai tạo và ức chế một cách đặc hiệu sự biểu hiện của các gen gây bệnh (Hình 4.1). Trước kia, thuật ngữ antisense bao hàm một vài nghĩa tuy khác biệt nhưng lại có quan hệ gần gũi như công nghệ antisense hay anticode, ribozym hay acid nucleic xúc tác (catalytic ribonucleic acid – RNA), triplex hay antigene và aptamer (Bảng 1). Cho tới nay vẫn chưa có thuật ngữ chuyên môn để mô tả các công nghệ trong lĩnh vực này. Mục đích sử dụng thuật ngữ trị liệu antisense trong chương này là cách tiếp cận antisense theo nghĩa kinh điển. Chúng ta sẽ đề cập tới ribozym và aptamer ở các chương sau.
Acid nucleic antisense là các oligonucleotid chuỗi đơn bổ cứu cho trình tự của một RNA hoặc DNA đích. Hơn 25 năm trước, Zamecnik và Stephenson lần đầu tiên giới thiệu phương pháp trị liệu antisense. Hơn nữa, RNA antisene tự nhiên đã được phát hiện với nghĩa là điều hòa biểu hiện gen trong các tế bào sống. Tuy nhiên, những phát hiện lý thú này không làm hấp dẫn các nhà nghiên cứu vì các thực nghiệm về trị liệu antisense trong thời kỳ 1970-1980 phát triển rất chậm.
Sau đột phá lớn về tổng hợp tự động các oligonucleotid người ta đã thu được một lượng đủ lớn oligonucleotid chất lượng cao cho các nghiên cứu in vitro và in vivo trên người, công nghệ antisense đã được phát triển nhanh chóng và được áp dụng rộng rãi trong nghiên cứu về chức năng và điều hòa gen, hiệu chỉnh biểu hiện gen và phê chuẩn các thuốc mới. Hiện nay đã có rất nhiều công trình nghiên cứu công bố về tiềm năng sử dụng các oligonucleotid trong điều trị bệnh cho người như bệnh cao huyết áp và các bệnh tim mạch khác, bệnh ung thư, các rối loạn di truyền và các bệnh nhiễm trùng do virus.
Thuốc antisense đầu tiên có tên là Vitravene được phê chuẩn để điều trị các bệnh viêm võng mạc do cảm ứng với cytomegalovirus. Một số antisense oligonucleotid đã tham gia trong các thử nghiệm lâm sàng pha I-II với tư cách là các tác nhân kháng ung thư (điều trị riêng rẽ hay kết hợp với hóa trị liệu thông thường).
Một phạm vi có quan hệ gần gũi là công nghệ RNA interference (RNAi). RNAi lần đầu tiên được phát hiện với tư cách là một cơ chế bảo vệ tế bào chống lại sự xâm lấn của các gen ngoại lai ở Caenorhaditis elegans và sau này cũng quan sát thấy ở nhiều loài nhân thực như côn trùng, cây cỏ, nấm và các động vật có xương sống. RNAi là một cơ chế nội bào có ảnh hưởng lớn đối với đặc hiệu trình tự, làm yên lặng gen hậu phiên mã để kiềm chế gen. Các RNA sợi kép được xử lý bởi Dicer – một enzym có tên là ribonuclease III của TB để tạo nên cặp đôi khoảng 21 nt với phần 3 nhô ra được gọi là small interfering RNA (siRNA) gián tiếp phân hủy RNA thông tin đặc hiệu trình tự. Các phân tử siRNA trong các TB động vật có vú còn có khả năng làm yên lặng một cách đặc hiệu sự biểu hiện gen. Vì vậy, công nghệ RNAi đã được sử dụng như là một thay thế mới và hiệu lực so với các công nghệ làm yên lặng gen khác như antisense và ribozym.
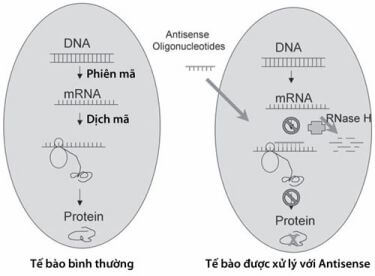
Hình 4.1. Mô hình đơn giản quá trình biểu hiện gen và những cơ chế tác động của antisense oligonucleotid. Antisense oligonucleotid sẽ bổ cứu với trình tự RNA đích. Nó lai tạo đặc hiệu với RNA đích dẫn đến ngừng quá trình phiên dịch và làm tăng sự phân giải RNA do hoạt tính của RNase H hoặc giảm đồng hóa RNA do ức chế sự ghép đôi của RNA.
(Theo Ruiwen Zhang và Hui Wang. (2005) Cancer Gene Therapy. Human Press. Totowwa, New Jersey)
Bảng 4.1. Những đặc tính chính của antisense và công nghệ RNAi
| và Công nghệ | Phân tử hoạt hóa | Đích phân tử | Vị trí tác động của TBa | Cơ chế tác động | Tình trạng phát hiện phát triển thuốc |
| Antisense | DNA hoặc | RNAb | Bào tương | Ngừng dịch mã, | Thử nghiệm lâm sàngc |
| RNA | hoạt hóa RNase H, | Thử nghiệm lâm sàng | |||
| ức chế ghép đôi, | |||||
| phá vỡ cấu trúc RNA | |||||
| Ribozym | RNA | RNA | Bào tương | Ngừng dịch mã, | Thử nghiệm lâm sàng |
| Hủy cấu trúc RNA | |||||
| Triplex- forming sàng | DNA | DNA | Nhân TB | Khóa phiên mã | Thử nghiệm tiền lâm |
| -oligonucleotid | |||||
| Aptamer | DNA hoặc | Protein | Nhân TB, bào | Can thiệp chức năng | Thử nghiệm lâm sàng |
| RNA | tương, hoặc | protein | pha I | ||
| ngoài TB | |||||
| RNAi | RNA | RNA | Bào tương | Thúc đẩy phân giải | Nghiên cứu in vitro, |
| RNA | giới hạn trong nghiên | ||||
| cứu in vivo |
Ghi chú: Vị trí tác độnga là vị trí khởi đầu của sự tương tác giữa các phân tử hoạt hóa với phân tử đích. RNAb là các RNA đích như pre –RNA, mRNA hoặc RNA của virus
Antisense đầu tiên là Vitravene được phê chuẩn để điều trị các bệnh viêm võng mạc do cảm ứng bởi cytomegalovirus. Một vài antisense khác đã được sử dụng trong các thử nghiệm lâm sàng pha I-II.
Ghi chú: PKC-protein kinase C; tiểu đơn vị điều hòa PKC-RIa I của protein kinase A phụ thuộc AMP vòng (cAMP)
Tuy nhiên, công nghệ này cũng còn nhiều giới hạn vì khi sử dụng các phân tử siRNA để điều hòa biểu hiện một gen đặc hiệu lại phụ thuộc sự cận đích và hiệu quả chuyển giao siRNA vào các TB đích. Phần lớn các báo cáo về công nghệ siRNA lấy từ các kết quả in vtro, còn hiệu ứng của việc sử dụng dài hạn in vivo thì vẫn chưa được xác định. Chúng ta sẽ còn đề cập tới các RNAi hay siRNA ở các mục khác.
CÔNG NGHỆ ANTISENSE
Hóa học antisense
Cả antisense RNA và DNA đều được sử dụng trong nghiên cứu chức năng gen bằng cách làm yên lặng biểu hiện gen đích.
Antisense RNA
Antisense RNA tự nhiên đã chứng minh được rằng có liên quan tới việc điều hòa gen ở các cơ thể bình thường. Các antisense RNA tổng hợp cũng đã được sử dụng cho các nghiên cứu in vitro. Vì các RNA cực kỳ nhạy cảm với sự phân giải của nuclease nên tiềm năng sử dụng về mặt dược lý học của antisense RNA bị hạn chế.
Trước đây đã có 2 cách tiếp cận chính về việc ứng dụng antisense trong các TB sống. Đó là biểu hiện nhân (nuclear expression) của antisense bởi các gen antisense công nghệ hóa và vi tiêm RNA antisense tổng hợp vào trong TB. Các antisense RNA đã cải biến hóa học được nghiên cứu với tư cách là các phân tử antisense RNA ổn định trong điều hòa xuống các gen liên quan tới ung thư.
Chẳng hạn như antisense 2-O-methyl RNA 30- mer nhắm vào thymidylat synthase (TS) mRNA đã thể hiện rõ là một tác nhân antisense có hiệu ứng in vitro. TS là một enzym chủ chốt chuyển hóa nucleotid và sự biểu hiện của nó được kiểm soát bởi protein của chính mình và sản phẩm TS cũng là một chất điều hòa âm tự động. Khi rối loạn điều hòa này sẽ làm tăng tổng hợp TS và có thể dẫn tới kháng thuốc của TB đối với các tác nhân kháng ung thư như 5-fluorouracil. Antisense 2-O-methyl RNA này đã được thiết kế nhắm trực tiếp vào yếu tố điều hòa hoạt tính ngược của 5 cis (nucleotid 80-109) của TS mRNA, nó cũng ức chế sự biểu hiện TS trong các tế bào RKO của ung thư kết tràng người, tùy thuộc vào liều lượng sử dụng.
Biểu hiện TS không bị tác động bởi việc xử lý với sense hoặc các kiểm soát không thích ứng.
Các nhà nghiên cứu cũng chứng minh rằng antisense 2-O-methyl RNA 18-mer nhắm vào trình tự cùng lõi (same core) thì cũng ức chế biểu hiện TS. Tuy nhiên, khi giảm hơn nữa kích cỡ oligonucleotid thì sẽ làm mất hoạt tính của antisense. Sau khi điều trị với antisense RNA thì mức protein TS cũng giảm thùy thuộc vào từng thời điểm và mức giảm cao nhất là sau 24 giờ biểu hiện oligonucleotid. Tuy nhiên, các phân tích Northern blot lại cho thấy TS mRNA không bị tác động bởi việc xử lý với antisense RNA và đời sống bán phần của protein TS không thay đổi sau khi xử lý bằng antisense. Điều đó chứng minh rằng cơ chế tác động của antisense RNA được trung gian qua một quá trình làm ngừng sự dịch mã, nhưng không liên quan gì tới tính ổn định của mRNA. Sự phát hiện này đã chỉ rõ rằng các antisense RNA khi đã được cải biến hóa học với thời gian ngắn có tiềm năng làm yên lặng các gen. Tuy nhiên, việc ứng dụng in vivo của các antisense RNA thì vẫn còn nhiều điều cần làm rõ.
Antisense DNA
Antisense oligodeoxynucleotide là các trình tự ngắn của DNA chuỗi đơn và có thể được sản xuất với số lượng lớn bằng tổng hợp hữu cơ tự động với nhiều bộ phận gắn kết (linkage) hay các nhóm tận cùng (terminal) đã được cải biến. Vì thế antisense DNA được sử dụng nhiều hơn antisense RNA và ribozym.
Các phosphodiester oligonucleotid chưa cải biến
Những phát hiện sớm về antisense được bắt đầu với phosphodiester oligonucleotid (PO-oligos). Do ái lực cao với các đích của chúng nên các PO-oligos gắn một cách ổn định vào mRNA đích và nhiệt độ chảy (melting temperature) Tm của PO-oligos RNA duplex là cao. PO-oligos cũng hoạt hóa RNase H, kết quả là làm phân giải mRNA (Hình 4.1). Bất lợi chính của PO-oligos là nhạy cảm với nuclease vì thế việc ứng dụng của các PO-oligos rất hạn chế.
Các tương đồng của oligonucleotid với bộ khung đã được cải biến
Nhiều nghiên cứu đã chứng minh rằng việc cải biến bộ khung oligonucleotid sẽ làm cho TB dễ tiếp thu hơn và làm tăng sự đề kháng với các nuclease của các antisene oligonucleotid. Trong số đó thì phosphothiat oligonucleotid – (PS-oligos) và methylphosphonat oligonucleotid (MP-oligos) được nghiên cứu nhiều nhất. Đối với các MP-oligos, năm 1970 lần đầu tiên Miller và cộng sự đã tổng hợp được hợp chất này với việc thay thế -CH3 bằng O và khẳng định sức đề kháng của hợp chất này đối với các nuclease nội và ngoại bào là rất cao. Điểm chảy của các MP-oligos như sau: RNA duplex cao hơn PO-oligos, vì oligonucleotid này không tích điện như các MP- oligos nên xuyên qua màng sinh chất dẽ hơn so với PO-oligos.
Bất lợi chính của các MP-oligos là hiệu ứng lai tạo tương đối thấp và bất lực với việc hoạt hóa RNase H. Khi thay thế isosteric oxy bằng sulfur trên gốc phosphor của DNA thì sẽ tạo được các PS-oligos. Cũng như các oligonucleotid khác, các PS-oligos vẫn duy trì trạng thái điện đích âm nên hòa tan trong nước nhiều hơn MP-oligos. Các PS-oligos cũng kháng các nuclease và dễ dàng hoạt hóa RNase H. Bất lợi của các PS- oligos là sự hấp thu TB kém và có độc tính không đặc hiệu in vivo. Do vậy, phần lớn các antisense oligonucleotid được test trên lâm sàng là các PS-oligos
Các oligonucleotid có cải biến đầu tận cùng
Các nghiên cứu cho thấy antisense oligonucleotid có thể bị phân giải ở đầu 3, đầu 5 hoặc ở cả 2 đầu 3 và 5. Để nâng cao sự hấp thu TB và sức đề kháng với nuclease của các oligonucleotid, nhiều cải biến ở đầu tận 5 hoặc 3 của các oligonucleotid đã được thực hiện. Chẳng hạn như các chất polylysine, avidin (acridine) và cholesterol đã được sử dụng để nâng cao sự hấp thu TB và hiệu ứng antisense của các oligonucleotid. Tuy nhiên, giá trị của những cải biến này vẫn chưa được xác định, đặc biệt là trong các thí nghiệm in vivo.
Các oligonucleotid với bộ khung hỗn hợp
Để nâng cao hơn nữa các đặc tinh cuả các antisense nucleotid người ta đã thiết kế các oligonucleotid bộ khung hỗn hợp (mixed backbone oligonucleotid MBO). Một loại MBO có các đoạn phosphorothiat ở đầu 3 và 5 và có một oligodeoxynucleotid cải biến hoặc một đoạn oligoribonucleotid định vị ở phần trung tâm của oligonucleotid này. Một số MBO thấy các đặc tính đã được nâng cao hơn các PS-oligos như: ái lực với RNA, hoạt hóa RNase H và hoạt tính kháng khối u. Thêm vào đó, nhiều dẫn liệu dược lý học có thể chấp nhận được trong phân giải in vivo và các khái luận dược động học đã thu lượm được từ các MBO này. Một trong số các MBO này đã được đưa vào thử nghiệm lâm sàng (Bảng 4.2). Một ví dụ khác của MBO có chứa các đoạn 2-5 ribo và 3-5 deoxyribonucleotid.
Các nghiên cứu về nhiệt độ chảy của các phosphodiester MBO chỉ rõ rằng sự hợp nhất 2-5 ribonucleotide vào 3-5 oligodeoxyribonucleotid đã làm giảm sự liên kết với các chuỗi đích khi so sánh với tất cả các 3-5 oligodeoxyribonucleotid có cùng chiều dài và trình tự. Khi tăng số liên kết 2-5 (từ 6 đến 10) thì sẽ làm giảm hơn nữa sự liên kết với chuỗi DNA đích. Các tương đồng của MBO làm mất ổn định của duplex với chuỗi DNA đích hơn là duplex với chuỗi RNA đích. Những MBO này thể hiện rõ sự ổn định khá cao đối với việc kháng lại nuclease.
Mặc dầu sự cải biến 2-5 không tạo hoạt tính cho RNase H và cũng không gây ảnh hưởng tới bản chất hoạt hóa RNase H của các đoạn 3-5 deoxyribonucleotid liền kề chỗ cải biến, nhưng nó lại tác động ít hơn tới sự tăng sinh TB, kéo dài thời gian đông máu và sự ly giải các thành phần hồng cầu so với các PS-oligos đối chứng. Những kết quả này đã chứng minh rằng với một số giới hạn các liên kết 2-5 cũng có thể gắn kết được với các PS-oligos để nâng cao hơn nữa các đặc tính antisense oligonucleotid với tư cách là các tác nhân trị liệu.
Các cơ chế tác động của antisense
Cơ chế chính xác về tác động của antisense oligonucleotid vẫn chưa được rõ hoàn toàn, nhưng có lẽ là rất phức tạp. Tuy nhiên hiện nay càng có nhiều bằng chứng ủng hộ cho ý kiến cho rằng hoạt tính sinh học của một antisense nucleotid rõ ràng là có thể bị ảnh hưởng bởi các yếu tố khác nhau ở mức phân tử, tế bào, tổ chức /mô và toàn cơ thể. Các yếu tố đó có thể là nồng độ oligonucleotid ở vị trí đích (RNA), nồng độ của RNA đích, sự chuyển hóa của RNA và các cơ chế tương tác giữa oligonucleotid và RNA đích của nó.
Nhiều cơ chế tác động của antisense đã được đưa ra, trong đó có 2 cơ chế chính, đó là dừng quá trình lai tạo và hoạt hóa RNase H (Hình 4.1). Các nghiên cứu trước đã chứng minh rằng antisense nucleotid gắn và tương tác với vùng mã hóa (code region) gây phong tỏa mRNA thông qua việc đọc của ribosome và dừng sự dịch mã (Hình 4.1). Sau này người ta đã chứng minh rằng antisense nucleotid cũng có thể đích tới vùng mã khởi đầu và ức chế xuống sự biểu hiện gen. Hơn nữa, các antisense oligonucleotid cũng có thể tạo ra hiệu ứng antisense thông qua việc gắn với vùng mũ 5, vùng 3 poly A và / hoặc vị trí ghép nối pre -RNA, và sau cùng là can thiệp tới sự ghép nối RNA, đột biến và vận chuyển.
Một cơ chế chủ chốt khác nữa của tương tác là hoạt hóa RNase H bởi một vài dạng antisense oligonucleotid như PS-oligos, nó có thể gắn với RNA đích của chúng để hình thành một RNA:DNA duplex, khi đó sẽ hoạt hóa enzym RNase H, kết quả là phân giải RNA đích. Tuy nhiên, các dạng khác của oligonucleotid như MP-oligos lại không có đặc tính này. RNase H của người đã được tách dòng và xác định đặc tính có thể tạo thuận lợi cho việc nghiên cứu cơ chế antisense. RNase người có chung nhiều đặc tính enzym như RNase H của E.coli. Enzym của người khi tách riêng RNA ra khỏi phức DNA:RNA duplex thì sẽ được các sản phẩm với các đầu tận cùng là 5’- phosphate và 3’-hydroxy như thế nghĩa là có thể bóc tách được phần RNA chuối đơn nhô ra nằm cạnh một DNA:RNA duplex, tuy nhiên nó không có khả năng phân giải các chất trong chuỗi RNA hoặc DNA có cải biến ở vị trí phân cắt 2’. Enzym của người có vận tốc phân cắt khởi đầu một heteroduplex có chứa RNA-phosphorothiat DNA lớn hơn so với RNA:DNA duplex. Một RNA:DNA duplex ngắn nhất có thể giúp cho việc cắt ngắn ra thành những mảnh 6 bp và một DNA:RNA với khe (gap- size) nhỏ nhất để rồi có thể cắt ngắn ra thành các mảnh 5bp. Những phát hiện này có thể tạo thuận lợi cho việc thiết kế các antisense nucleotide phụ thuộc RNase H.
Nhìn chung, có thể coi tác động của RNAi như kiểu cơ chế tác động của một antisense, nó sử dụng một RNase chuỗi kép để thúc đẩy thủy phân RNA đích. Veckers và cộng sự đã so sánh hiệu quả của antisense nucleotid được thiết kế tối ưu nhất với cách hoạt động theo cơ chế RNAi của các oligonucleotid để thiết lập phương thức tác động theo cơ chế phụ thuộc RNase H trên các tế bào người. Các nhà nghiên cứu thấy rằng những oligonucleotid này có thể xứng đáng với các thuật ngữ: tiềm năng, hiệu quả tối đa, kéo dài sự tác động và đặc hiệu trình tự. Hơn nữa, hoạt tính của cả siRNA oligonucleotid cũng như oligonucleotid phụ thuộc RNase H đều bị tác động bởi cấu trúc bậc hai của mRNA đích. Khi kiểm tra 80 siRNA oligonucleotid duplex được thiết kế để gắn vào RNA từ 4 gen người khác loại đã cho thấy: nhìn chung có sự tương hỗ hoạt tính giữa các oligonucleotid phụ thuộc RNase H khi nhắm vào cùng một vị trí. Một khác biệt lớn giữa 2 cách tiếp cận này là các oligonucleotid phụ thuộc RNase H có hoạt tính kháng lại các đích trên pre -mRNA, trong khi đó siRNA lại không có hoạt tính này. Phát hiện này đã chứng minh rằng cả công nghệ dựa trên nền tảng siRNA cũng như công nghệ anisense phụ thuộc RNase H đều là những cách tiếp cận hiệu quả để đánh giá chức năng gen, ít nhất là ở các thí nghiệm với nền tảng tế bào. Tuy nhiên, những phát hiện này liệu có hiệu lực in vivo hay không thì vẫn cần được xác định.
Nguyên lý thiết kế antisense
Mặc dầu mẫu thiết kế antisense oligonucleotid về lý thuyết là đơn giản (chỉ để nhận dạng một oligonucleotid bổ cứu trên cơ sở các trình tự trên mRNA). Nhưng việc lựa chọn được một antisense oligonucleotid đặc hiệu và hiệu quả lại là một vấn đề lớn thuộc về kinh nghiệm nghiên cứu cũng như các kết quả thực nghiệm. Hơn nữa, vì các trình tự của oligonucletid xác định như CpG và GGGG là để chỉ sự phụ thuộc trình tư (sequence – dependent) và hiệu ứng không antisense (non-antisense effect). Những trình tự này cần phải tránh khi nhận dạng các thuốc antisense đặc hiệu trình tự (sequence-specific antisense drugs). Một số cách tiếp cận phổ thông là lựa chọn một trình tự antisense tối ưu như chúng ta sẽ bàn luận dưới đây.
Cách tiếp cận bách bộ – trình tự ngẫu nhiên (random sequence walkingr)
Phương pháp bách bộ – trình tự dựa trên cơ sở quy luật cặp đôi base của Watson -Crick đối với một trình tự đã biết của gen đích theo một đường thẳng để thiết kế và lựa chọn các antisense oligonucleotid. Thông thường thì khá nhiều oligonucletid ngẫu nhiên (10-100 phụ thuộc vào chiều dài của gen khảo sát) có chiều dài xác định (15-25 mer) nhắm vào các vùng khác nhau của mRNA đích đã được tổng hợp một cách tách biệt và hoạt tính antisense của chúng được xác định bằng cách sử dụng một tấm chắn với cơ sở tế bào hoặc phi tế bào in vitro. Đây là phương pháp thông dụng đã được sử dụng trong nhiều thí nghiệm về antisense và đã thu được những kết quả tốt mặc dầu tốn kém và mất nhiều thời gian, công sức (chỉ dưới 5% oligonucleotid được phát hiện là có hiệu ứng).
Chọn lọc đích với sự trợ giúp của máy tính
Khi áp dụng các phương pháp trên người ta thường thấy có sự thay đổi một hoặc một vài base, đó là sự thay đổi không có ý nghĩa về mặt cấu trúc oligonucleotid nhưng lại có thể tạo nên những khác biệt về hoạt tính antisense. Hiệu lực của các oligonucleotid bổ cứu cho RNA đích xác định chủ yếu bởi cấu trúc bậc 2 và 3 của RNA đích. Vì thế hiệu quả của các antisense oligonucleotid có thể liên quan rất nhiều tới khả năng của các vị trí có thể được sử dụng làm đích cho các RNA đích. Những vị trí có thể sử dụng được trong mRNA lại có thể đoán trước được nếu sử dụng một chương trình máy tính thông qua các cách tiếp cận khác nhau để tiên đoán cấu trúc bậc 2 của RNA. Chẳng hạn như khi sử dụng chương trình gấp nếp RNA (RNA- folding program) như MFOLD (genetics Computer Group, Madison, WI) thì các antisense oligonucleotid có thể được thiết kế để kháng lại các vùng đích của mRNA (đã dự đoán trước) dựa trên sự cặp đôi phân tử của các base, vì thế mà nó có thể được sử dụng trong thiết kế các oligonucleotid.
Các dãy oligonucleotid
Những ích lợi trong công nghệ dãy DNA (DNA array technology) đã dẫn đến việc phát triển các dãy quét oligonucleotid như là một phương pháp mới để xác định các antisense oligonucleotid hoạt tính. Phương pháp này cho phép tổng hợp tổ hợp một lượng lớn oligonucleotid song song với việc đo lực liên kết của tất cả các oligonucleotid với mRNA đích. Cũng có thể là mối tương quan giữa lực liên kết và hoạt tính antisense đã tạo cơ sở cho sự tối ưu hóa các antisense oligonucleotid. Tuy nhiên, phương pháp này vẫn chưa được test rộng rãi trong các nghiên cứu antisense.
Sàng lọc dựa trên cơ sở sự phân giải của RNase H
Như đã đề cập ở trên, hoạt hóa RNase H là một trong các cơ chế chính của antisense, đặc biệt là các PS-oligos. Các thí nghiệm lâm sàng RNase H có thể được kết hợp sử dụng cùng với thư viện oligonucleotid ngẫu nhiên hoặc bán ngẫu nhiên để đi tới tối ưu hóa các oligonucleotid; mRNA đích được phiên mã in vivo với các đuôi đánh dấu và trộn lẫn với thư viện oligonucleotid; các vị trí phân cắt của RNase H sau đó được xác định bằng điện di trên gel. Tuy nhiên, phương pháp này cũng chưa xác định được một cách chính xác các vị trí có thể dùng được của mRNA đích bởi vì sự phân giải của RNase H có thể xảy ra ở nhiều hơn một vị trí. Vì thế sẽ khó mà đoán trước được hoạt tính anisense đơn lẻ trên cơ sở RNase mapping.
CÁC NGUYÊN LÝ ĐÁNH GIÁ ANTISENSE
Cũng như các loại thuốc mới khác, việc trị liệu bằng oligonucleotid cũng cần phải trải qua quá trình đánh giá một cách hệ thống và lâu dài trong các thử nghiệm tiền lâm sàng và lâm sàng (Hình 4.2 và 4.3). Hoạt tính sinh học của một thuốc antisense bao hàm các hiệu ứng mong muốn và không mong muốn có thể bị ảnh hưởng bởi nhiều yếu tố khác nhau từ mức phân tử, tế bào, tổ chức /mô hay toàn cơ thể (Bảng 4.3 và 4.4). Các antisense oligonucleotid có thể gây các hiệu ứng sinh học lên các gen đích thông qua một vài cơ chế riêng biệt bao gồm cả cơ chế antisense và không antisense trên các tế bào hoặc mô đích hay không đích.
Hơn nữa, việc chuyển giao các thuốc antisense tới được các tế bào đích là vấn đề then chốt đi đến thành công. Trong các nghiên cứu in vivo, các lipid thường được sử dụng để tạo thuận lợi cho sự hấp thu của tế bào đối với các oligonucleotid. Nhưng cũng cần phải lưu ý rằng, tỷ lệ lipid đối trong các oligonucleotid sẽ tác động tới kết quả hấp thu cũng như các hoạt tính sinh học của oligonucleotid. Độc tính TB của riêng một lipid xác định cũng cần phải được lý giải trong các kết quả in vivo. Trái lại trong các nghiên cứu in vivo thì việc hấp thu oligonucleotid dường như là tốt hơn so với các thí nghiệm in vitro. Do vậy có lẽ cũng không cần phải sử dụng một phương tiện vận chuyển đặc biệt cho các oligonucleotid.
Đánh giá dược lý học
Đã có một số lượng lớn các báo cáo mô tả các tính chất dược động học của nhiều loại antisense oligonucleotid. Các antisense oligonucleotid với các chiều dài và các thành phần base khác nhau đã được đánh giá ở các mẫu khác nhau như ở chuột lớn, chuột nhắt, thỏ, khỉ và người với các phương thức đưa vào cơ thể khác nhau (qua tĩnh mạch, trong màng bụng, dưới da, trong cơ, uống và hít). Trong hầu hết cấc trường hợp, hàm lượng oligonucleotid gốc (parent) và các sản phẩm đã bị phân giải (trong một số trường hợp) được báo cáo là trên các mẫu huyết tương.
Trong một số nghiên cứu khác người ta đã phân phối các oligonucleotid tới nhiều mô khác. Nhìn chung là PS-oligos có đời sống phân phối bán phần huyết tương ngắn t1/2 dưới 1 giờ và đời sống loại thải bán phần lại rất dài t1/2 ở thang 40 -60 giờ.
Dược động học huyết tương của các oligonucleotid không liên quan tới chiều dài hay trình tự bậc nhất, trừ trường hợp các oligonucleotid đã cải biến khung và có các đoạn đặc hiệu ở đầu 3 và /hoặc đầu 5. Các antisense oligonucleotid được phân phối nhiều với nồng độ cao nhất ở gan và thận. Bài tiết qua nước tiểu có lẽ là con đường loại thải chính.
Việc duy trì oligonucleotid trong các mô đích và các mô bình thường liên quan trực tiếp tới tính ổn định in vivo. Để tăng hiệu ứng trị liệu cần phải tăng thời gian duy trì của các oligonucleotid nguyên vẹn trong cơ thể bằng cách làm tăng tính ổn định in vivo và giảm bài tiết. Các nghiên cứu tại phòng thí nghiệm cho thấy các MBO kéo dài sự duy trì tại mô hơn các PS-oligos. Tuy nhiên, vì sự phân phối mô không đặc hiệu và có sự tích lũy nên khi duy trì các mức (nồng độ) cao và kéo dài oligonucleotid trong các mô vật chủ thì có thể sẽ làm tăng rủi ro. Hơn nữa, độc tính và sự rủi ro này có thể tăng hơn nữa tùy thuộc trạng thái bệnh của từng cá thể cũng như chức năng của các tổ chức như gan và thận.
Đánh giá hiệu lực antisense
Có lẽ khía cạnh quan trọng nhất của các antisense oligonucleotid là hiệu ứng đích và tính đặc hiệu của các tác nhân antisense này (Hình 4.2, Bảng 4.3). Các oligonucleotid đã được thiết kế thường được test ở cả mức in vitro và in vivo (Hình 4.2). In vitro các thử nghiệm dựa trên cơ sở TB hoăc phi TB đã được sử dụng một cách thường quy để xác lập nền tảng cho những nghiên cứu xa hơn. Sự hấp thu TB của các oligonucleotid được test có lẽ phụ thuộc vào dạng TB, nồng độ thuốc, các điều kiện nuôi cấy TB và hệ thống chuyển giao. Nói chung, có thể chấp nhận được rằng phần lớn các oligonucleotid có thể vượt qua màng TB vào tận tế bào chất với một hàm lượng đủ để đạt tới hiệu ứng mong muốn.
Để tăng hấp thu TB in vitro, một vài phương tiện chuyển giao như liposome hoặc phospholipid đã được sử dụng có tính chất thường quy để tránh việc phải sử dụng nồng độ antisense cực kỳ cao trong những ngày đầu nghiên cứu.
Để chứng minh tính đặc hiệu của các oligonucleotid được test, mức độ biểu hiện của gen đích, người ta thường sử dụng phương pháp Western blot, phản ứng tổng hợp chuỗi phiên mã ngược (reverse transcriptase polymerase chain reaction RT- PCR) và / hoặc các phân tích Northern blot. Nếu muốn khảo sát sự ức chế biểu hiện protein và những tác động lên sự chuyển hóa mRNA của các gen đích theo thời gian, liều lượng, cách thức phụ thuộc trình tự thì phải xác định được hiệu ứng đặc hiệu antisense. Cũng phải thực hiện các kiểm chứng đặc biệt (chưa xử lý, oligo không thích hợp, các lipid). Để chứng minh xa hơn nữa tính đặc hiệu của các antisense oligonucleotid được test thì việc kiểm soát các protein hay các gen quản gia chẳng hạn như actin cũng phải được phân tích đồng thời.
Các thử nghiệm nhằm xác định những biến đổi, sự tăng sinh và apoptosis TB cũng được sử dụng để vẽ được bức tranh tổng thể về hoạt tính kháng u của các oligonucleotid được test khi so sánh với các đối chứng. Tuy nhiên, những thử nghiệm này cũng có thể tạo ra các kết quả dương tính giả hay âm tính giả. Chẳng hạn như, một số lipid được dùng để nâng cao sự hấp thu oligonucleotid lại có độc tính đối với TB. Vì thế, các kiểm chứng đặc biệt (âm tính, dương tính, không xứng đôi) là rất cần thiết. Các đáp ứng về liều lượng, thời gian và sự phụ thuộc trình tự là những bằng chứng tốt đối với hiệu ứng antisense cũng như việc thiết lập nền tảng cho những đánh giá in vivio xa hơn cho các oligonucleotid được test.
Bằng chứng về hoạt tính kháng u in vivo của các antisense oligonucleotid là rất quan trọng đối với việc phát triển đường dây thông tin. Nhưng thật khó mà tạo được các kết quả làm cho người ta tin tưởng như là với các test in vitro. Các mô hình trên các loại chuột như mô hình ghép ngoại lai trên chuột nude và SCID trên chuột nhắt cũng như các mô hình chuột chuyển gen cũng thường hay được sử dụng nhất trước khi đi tới các thử nghiệm lâm sàng. Đích cuối cùng của hiệu ứng này là các số liệu về khối lượng khối u, sự di căn, sự sống sót, các marker phân tử và sự đánh giá mô bệnh học.
Có 3 mô hình test có thể được sử dụng – phụ thuộc vào lịch trình và thời gian điều trị. Thứ nhất là hiệu ứng đối với khởi đầu ung thư và việc tạo ra các oligonucleotid. Vấn đề này có thể xác định được khi sử dụng một protocol ex vivo trong đó các TB đã được xử lý với các antisense oliogonucleotide trước khi ghép ngoại lai TB. Tốc độ hình thành khối u và sự ức chế tăng trưởng có thể được coi như là đích chính trong các mô hình này.
Thứ hai là, hiệu ứng ức chế tăng trưởng khối u của các oligonucleotid test có thể được thực nghiệm với việc sử dụng một proptocol xử lý in vivo, trong đó việc xử lý bằng oligonucleotid được bắt đầu ở giai đoạn sớm của tăng trưởng khối u, thường là khi khối u đạt tới 50-100mg. Trong các mô hình này, ức chế tăng trưởng khối u và các marker phân tử / bệnh lý là đích chính cuối cùng.
Thứ ba là, hoạt tính kháng u của các oligonucleotid có thể được test ở các khối u giai đoạn muộn, khi đó người ta sử dụng một protocol mà việc xử lý bằng oligonucleotid bắt đầu khi khối lượng khối u đạt tới 500-1000mg, tùy thuộc vào từng dạng khối u. Trong những mô hình này, ức chế tăng trưởng khối u và sự sống sót có thể là đích chính cuối cùng.
Việc thiết kế mối tương quan đáp ứng liều trong các mô hình in vivo là rất quan trọng. Các kiểm chứng đặc biệt (không xử lý, chất dẫn thuốc, oligonucleotid) cũng cần được đề cập, Bằng chứng in vivo về việc ngăn chặn biểu hiện gen đặc hiệu cũng là điều mà người ta mong mỏi. Cần phải chỉ rõ rằng, hoạt tính kháng u in vivo của một antisense oligonucleotid đã biết không nhất thiết phải là kết quả tất yếu của cơ chế antisense mà nó còn có thể liên quan tới cả hoạt tính không đặc hiệu và /hoặc hoạt tính kháng antisense đặc hiệu trình tự.
Trị liệu kết hợp
Mặc dầu hầu hết các antisense oligonucleotid được test in vivo với tư cách là trị liệu đơn, nhưng các phương pháp điều trị kết hợp giữa antisense oligonucleotid và các tác nhân hóa trị thông thường, các kháng thể kháng ung thư và xạ trị cũng được nghiên cứu với diện rộng. Có nhiều nghiên cứu lâm sàng đã chứng minh rằng sự điều hòa xuống các sản phẩm gen đặc hiệu với antisense oligonucleotid làm các TB ung thư nhạy cảm với các tác nhân hóa trị, kết quả là có hoạt tính cộng hoặc đồng thuận kháng ung thư. Đích của các antisense này là receptor yếu tố tăng trưởng bì của chuột double minutes 2 (MDM2), protein kinase c-myc phụ thuộc AMP vòng (cAMP), protein kinase C và Bcl-2. Những antisense oligonucleotid này làm tăng hiệu ứng trị liệu của các tác nhân hóa trị như paclitaxel, 5-fluorouracil, cisplatin, carboplatin, taxotere, camtothecin, irinotecan, leucovorin, gemcitabin, mefosfamid, doxorubicin, adramycin và dacarbazin.
Tuy nhiên, cơ chế đáp ứng cho hiệu ứng cộng hay đồng thuận như thế giữa các antisense oligonucleotid và các tác nhân hóa trị thì vẫn chưa được rõ hoàn toàn. Có thể cả yếu tố động dược học và dược động lực đều có thể liên quan tới cơ chế này (Bảng 4.3). Sự đồng thuận giữa 2 lớp tác nhân có thể dẫn đến từ sự tương tác trên một số cơ chế, chẳng hạn như sự làm ngừng chu kỳ tế bào, cảm ứng apoptosis, cảm ứng đáp ứng miễn dịch và sản xuất các cytokin. Mặc dầu hầu hết các nghiên cứu đã chỉ ra rằng hiệu ứng cộng hay đồng thuận như thế là do sự đặc hiệu trình tự, nhưng các nghiên cứu khác lại chứng minh rằng các antisense oligonucleotid cũng có thể làm cho irinotecan có tiềm lực kháng u trong phương thức độc lập trình tự – có thể là thông qua một tương tác ở mức dược động học và / hoặc chuyển hóa đã làm tăng sự chuyển đổi của các chất chuyển hóa hoạt tính.
Các thử nghiệm lâm sàng
So với các thử nghiệm tiền lâm sàng thì các nghiên cứu lâm sàng về oligonucleotid có số báo cáo ít hơn (Bảng 4.2). Hầu hết các antisense oligonucleotid đã được test là các PS-oligos, sơ bộ cho thấy độ nan toàn là có thể chấp nhận được và có hiệu lực kháng u ở giai đoạn khởi đầu trên người. Các antisense oligonucleotid đã được test với tư cách là trị liệu đơn cũng như trị liệu kết hợp với các tác nhân hóa trị khác.
Trong hầu hết các kết quả thử nghiệm pha I đã được báo cáo thì các antisense oligonucleotid có độ an toàn tốt. Các tác dụng phụ bao gồm: giảm tiểu cầu, kéo dài thời gian tạo cục đông đã được hoạt hóa cục bộ, tăng nhẹ các men gan. Độc tính với thận và gan không đánh kể. Các nghiên cứu động dược học được thực hiện trên các bệnh nhân đã chỉ rõ rằng: đời sống bán phần của sự phân phối huyết tương là ngắn nhưng lại kéo dài đời sống bán phần bài tiết. Bài tiết qua nước tiểu là con đường chính với các sản phẩm đã bị phân giải. Ngày nay, các antisense oligonucleotid đã thể hiện có thể ức chế được sự biểu hiện các gen đích và đáp ứng kháng u khởi đầu một cách đặc hiệu. Những hạn chế của các thử nghiệm pha II và III cũng đã được báo cáo và thấy cũng cần phải có các nghiên cứu xa hơn nữa. Trên thực tế, tương lai của trị liệu antisense sẽ còn phụ thuộc vào những thành công trong các thử nghiệm lâm sàng.
Đánh giá độ an toàn
Các nghiên cứu kỹ lưỡng về độc chất học là chìa khóa cho sự phát triển thuốc antisense. Cũng có một vài giới hạn về độc chất học đã được báo cáo trong các đánh giá về antisense oligonucleotid, mặc dầu có nhiều phosphorothiat đã được nghiên cứu mở rộng về độ an toàn của chúng trên một vài mẫu như chuột nhắt, chuột lớn, khỉ và người. Các hiệu ứng phụ lệ thuộc liều trong các thí nghiệm ở chuột lớn và chuột nhắt bao gồm: giảm tiểu cầu, phì đại lách và tăng transaminase. Những biến đổi mô bệnh học bao gồm: thâm nhiễm TB đơn nhân trong các mô như gan, thận và lách cũng như tăng sản các TB lưới nội mô và các TB lympho. Sự khốc liệt của các hiệu ứng phụ phụ thuộc vào liều lượng, tần suất và thời gian sử dụng các oligonucleotid. Nhìn chung khái lược về độc chất học của các PS-oligos có các thành phần base và chiều dài khác nhau là tương tự nhau, trừ khi có sự hiện diện của một motif trình tự xác định chẳng hạn như CpG -dinucleotid và motif poly -G. Những motif này góp phần làm nghiêm trọng thêm về độc chất học.
Các nghiên cứu về độc chất học tiền lâm sàng đã được sử dụng để chỉ dẫn cho kế hoạch thử nghiệm lâm sàng về về liều khởi đầu và liều tăng dần. Để củng cố cho các thử nghiệm lâm sàng pha I, người ta nghiên cứu độc chất học trên động vật với việc sử dụng 2 mẫu động vật, thường là một mẫu là loài gặm nhấm và một mẫu không phải là gặm nhấm. Đối với các antisense oligonucleotid thì các động vật cao cấp không phải là người thường được sử dụng trong các thử nghiệm. Hơn nữa, các nghiên cứu độc chất học đặc hiệu cũng được đề xướng để xác định độc chất học tim, độc chất học gan và độc chất học miễn dịch.
KẾT LUẬN
Mặc dầu đã có những tiến bộ đáng kể trong thập kỷ qua, nhưng các antisense oligonucleotid vẫn chưa được phát triển với tư cách là một phương pháp trị liệu hợp thức. Một trong số các khía cạnh quan trọng nhất của việc phát triển các antisense oligonucleotid là phê chuẩn các các đích thuốc và nâng cao hiệu lực cũng như tính đặc hiệu đích của các thuốc antisense này. Với việc ngày càng gia tăng các antisense oligonucleotid kháng ung thư đã được đánh giá trên lâm sàng thì hy vọng sẽ có các tác nhân trị liệu một cách đơn lẻ hay kết hợp cùng với các tác nhân trị liệu khác. Các nghiên cứu tương lai rất cần thiết vì nó không chỉ là cung cấp các nguyên lý cơ bản của công nghệ antisense in vitro và in vivo mà còn làm thỏa mãn đầy đủ các nhu cầu của trị liệu. Các nghiên cứu cơ bản cũng rất cần thiết nhằm khám phá ra các cơ chế tác động tới các hoạt tính sinh học của các oligonucleotid. Với các thuốc antisense thế hệ mới đã được sáng chế và kiểm định, hy vọng rằng hiệu ứng trị liệu và độ an toàn của các tác nhân này sẽ được nâng cao một cách đáng kể.
