Đặc trưng bởi albumin niệu (>3.5 g/ngày) và giảm albumin máu (<30g/l) và kèm theo phù, tăng mỡ máu, và lipid niệu. Bài tiết protein có thể được định lượng bằng nước tiểu 24 giờ hoặc bằng cách tính tỉ lệ protein/creatinin hoặc albumin/creatinin khi lấy nước tiểu ngẫu nhiên. Định lượng bài tiết creatinin giúp xác định sự phù hợp của nước tiểu 24 giờ: bài tiết creatinin hàng ngày nên từ 20–25 mg/kg trọng lượng cơ ở nam và 15–20 mg/kg trọng lượng cơ ở nữ. Đối với mẫu nước tiểu ngẫu nhiên, tỉ lệ protein/creatinin hay albumin/creatinin (mg/dl) xấp xỉ lượng protein bài tiết trong 24 giờ, khi bài tiết creatinin chỉ hơi lớn hơn 1000 mg/ngày/1.73 m2. Tỉ lệ protein/creatinin bằng 5 tương đương với 5 g/ngày/1.73 m2. Định lượng bài tiết protein niệu trong mẫu nước tiểu ngẫu nhiên đã thay thế phần lớn cho định lượng nước tiểu 24 giờ, do dễ dàng làm hơn và cần phải kiểm tra lại bộ nước tiểu 24 giờ hoàn chỉnh. Tỉ lệ protein toàn phần/creatinin không phát hiện được microalbumin niệu, mức độ bài tiết albumin dưới ngưỡng phát hiện của test protein toàn phần; phép đo tỉ lệ albumin/creatinin niệu được dùng nhiều hơn như một công cụ sàng lọc protein niệu mức thấp hơn.
Ngoài phù, biến chứng của hội chứng thận hư có thể kể đến như huyết khối tĩnh mạch và các biến cố huyết khối tắc mạch khác, nhiễm trùng, thiếu vitamin D, suy dinh dưỡng protein năng lượng, và ngộ đôch thuốc do giảm chất gắn với protein.
Ở người lớn, nguyên nhân thường gặp nhất của hội chứng thận hư là đái tháo đường. Một số ít trường hợp là thứ phát sau lupus ban đỏ hệ thống, bệnh thoái hóa dạng bột, do thuốc, tạo u, hoặc các rối loạn khác (Bảng).
Bảng. NGUYÊN NHÂN CỦA HỘI CHỨNG THẬN HƯ

Bằng cách loại trừ, số còn lại là vô căn. Ngoại trừ bệnh thận do đái tháo đường, sinh thiết thận là cần thiết để chẩn đoán và xác định điều trị trong hội chứng thận hư.
Bệnh thay đổi tối thiểu
Là nguyên nhân của 10–15% hội chứng thận hư vô căn ở người lớn, nhưng 70–90% hội chứng thận hư ở trẻ em. Huyết áp bình thường; mức lọc cầu thận bình thường hoặc giảm nhẹ; cặn nước tiểu là bình thường hoặc có một ít hồng cầu. Protein chọn lọc có thể thay đổi ở người lớn. Nhiễm trùng đường hô hấp trên gần đây, dị ứng, hoặc tiêm chủng có thể có trong một vài trường hợp; các thuốc chống viêm non-steroid có thể gây nên bệnh thay đổi tối thiểu với viêm kẽ thận.Suy thận cấp có thể xảy ra (hiếm), đặc biệt ở người già. Sinh thiết thận chỉ cho thấy hợp nhất chân trên kính hiể vi điện tử. Sự giảm protein niệu khi dùng Glucocorticoid mang đến một tiên lượng tốt; Liệu pháp gây độc tế bào có thể cần thiết nếu tái phát. Tiến triển đến suy thận là không thường gặp. Một vài trường hợp kháng liệu pháp steroid nghi ngờ là xơ hóa khu trú.
Viêm cầu thận màng
Được đặc trưng bởi lắng đọng IgG dưới biểu mô; chiếm tới ~30% của hội chứng thận hư vô căn ở người lớn. Bệnh nhân có phù và protein niệu trong thận hư. Huyết áp, mức lọc cầu thận và cặn nước tiểu luôn bình thường trong giai đoạn đầu. Tăng huyết áp, suy thận mức độ nhẹ, và bất thường cặn nước tiểu tiến triển muộn hơn. Huyết khối tĩnh mạch thận là tương đối phổ biến, nhiều hơn các thể khác của hội chứng thận hư. Các bệnh nền như lupus ban đỏ hệ thống, viêm gan B và các khối u rắn và tiếp xúc với các thuốc như liều cao Captopril hoặc Penicillamin nên được tìm kiếm. Phần lớn bệnh nhân viêm cầu thận màng vô căn được phát hiện có lưu hành tự kháng thể với typ M phospholipase A2 (PLA2R), được thể hiện trong tế bào có chân cầu thận.Một số bệnh nhân tiến triển tới bệnh thận giai đoạn cuối; tuy nhiên, 20–33% có thể thuyên giảm tự nhiên. Giới nam, tuổi già, tăng huyết áp và protein niệu đáng kể (>6 g/ngày) kéo dài có thể liên quan đến một nguy cơ cao của tiến triển bệnh. Điều trị ức chế miễn dịch tối ưu là một tranh cãi.
Điều trị Glucocorticoid đơn độc là không hiệu quả. Thuốc gây độc tế bào có thể giúp bệnh thuyên giảm hoàn toàn hoặc một phần ở một số bệnh nhân, như là Cyclosporin. Liệu pháp kháng thể kháng CD20 với Rituximab gần đây cho thấy những hứa hẹn đáng kể, phù hợp với vai trò của tế bào B và kháng thể kháng PLA2R trong sinh lý bệnh. Làm giảm protein niệu với thuốc ức chế men chuyển và/hoặc ức chế thụ thể angiotensin cũng là một liệu pháp chính trong điều trị.
Bệnh xơ cứng cầu thận khu trú
Có thể là nguyên phát hoặc thứ phát. Bệnh nguyên phát có xu hướng cấp tính hơn, giống với bệnh thay đổi tối thiểu trong tính đột ngột của hội chứng thận hư, nhưng có thêm các đặc điểm của tăng huyết áp, suy thận và đái máu. Liên quan đến xơ cứng các phần của một vài tiểu cầu thận (chủ yếu ở gần tủy thận) và được tìm thấy trong ~35% bệnh nhân với hội chứng thận hư. Có nhiều dưới nhóm bệnh lý khác nhau của xơ cứng cầu thận khu trú vô căn có ý nghĩa tiên lượng. Đặc biệt, biến thể “bệnh cầu thận xẹp” có bệnh lý tương tự như bệnh thận liên quan đến HIV (HIVAN); tất cả đều gây nên bệnh tiến triển nhanh.
Người Mỹ gốc Phi bị ảnh hưởng rất nhiều bởi bệnh xơ cứng cầu thận khu trú, bệnh thận liên quan đến HIV và những bệnh thận không liên quan đến đái tháo đường khác, với tỷ lệ cao hơn, nhạy cảm hơn (HIVAN), và một nguy cơ cao hơn dẫn đến bệnh thận giai đoạn cuối. Những biến thể của đặc trưng của người châu Phi trong gen APOL1 – gen mã hóa apolipoprotein L1 có trong tế bào có chân cầu thận, gần đây được nhắc đến làm tăng nguy cơ di truyền.
Điều trị xơ cứng cầu thận khu trú nguyên phát bắt đầu với một đợt Steroid kéo dài; ít hơn một nửa bệnh nhân có sự thuyên giảm bệnh. Cyclosporin là một liệu pháp thay thế để bảo tồn sự thuyên giảm và cho những bệnh nhân không đáp ứng với Steroid. Cũng như trong những bệnh cầu thận khác, giảm protein niệu với thuốc ức chế men chuyển và/hoặc ức chế thụ thể angiotensin là một phần của điều trị. Cuối cùng, bệnh xơ cứng cầu thận khu trú nguyên phát có thể trở lại sau ghép thận, khi nó có thể dẫn đến mất các mô ghép cùng loài.
Bệnh xơ cứng cầu thận khu trú thứ phát có thể xảy ra ở giai đoạn muộn của bất cứ bệnh thận nào liên quan đến mất nephron (viêm cầu thận từ trước, viêm bể thận, bệnh hồng cầu hình liềm, trào ngược bàng quang-niệu đạo). Điều trị bao gồm kháng protein niệu bằng thuốc ức chế men chuyển và kiểm soát huyết áp. Glucocorticoid không có tác dụng trên bệnh xơ cứng cầu thận khu trú thứ phát. Bệnh sử, kích thước thận, kết quả sinh thiết và các điều kiện liên quan luôn cho phép phân biệt bệnh là nguyen phát hay thứ phát.
Viêm cầu thận màng tăng sinh
Mở rộng màng và tăng sinh đến tận vòng mao mạch. Hai biến thể siêu cấu trúc cùng tồn tại. Trong viêm cầu thận màng tăng sinh I, có sự lắng đọng điện tử dày đặc ở dưới nội mô, C3 lắng đọng ở các hạt liên quan đến bệnh phức hợp miễn dịch, IgG và những thành phần sớm của bổ thể có thể có hoặc không.
Ở bệnh viêm cầu thận màng tăng sinh II, lớp đặc của màng đáy cầu thận bị chuyển thành lớp dày đặc điện tử, giống như màng đáy ở bao Bowman và ống thận. C3 không thường xuyên được tìm thấy ở màng đáy cầu thận. Có mặt một số lượng nhỏ Ig (thường là IgM), nhưng những thành phần sớm của bổ thể thì vắng mặt. Nồng độ bổ thể huyết thanh giảm. Bệnh viêm cầu thận màng tăng sinh ảnh hưởng tới người trẻ trưởng thành. Bất thường huyết áp và mức lọc cầu thận, và cặn nước tiểu hoạt động. Một số có viêm thận cấp hoặc đái máu. Tổn thương giống nhau ở lupus ban đỏ hệ thống và hội chứng tan máu urê máu. Nhiễm trùng với viêm gan V có liên kết với viêm cầu thận màng tăng sinh, thường liên quan đến bệnh cryoglobulin huyết. Điều trị với Interferon α và Ribavirin có hiệu quả trong làm thuyên giảm bệnh thận ở một số trường hợp, tùy thuộc vào typ huyết thanh vủa viêm gan C; tuy nhiên, suy thận đặc biệt không đáp ứng với liệu pháp Ribavirin. Glucocorticoid, thuốc gây độc tế bào, chống kết tập tiểu cầu và liệu pháp huyết tương tinh chế được sử dụng với độ thành công hạn chế; Rituximab là một liệu pháp mới với các bằng chứng có lợi nhiều hơn. Viêm cầu thận màng tăng sinh có thể tái phát khi ghép mô cùng loài.
Bệnh thận do đái tháo đường
Là nguyên nhân hay gặp nhất của hội chứng thận hư. Dù giai đoạn trước của đái tháo đường có thể thay đổi, ở typ 1 protein niệu có thể tăng sau 10–15 năm từ khi phát bệnh, tiến triển tới hội chứng thận hư và sau đó đến suy thận sau 3–5 năm. Bệnh võng mạc gần như phổ biến ở bệnh nhân đái tháo đường typ 1 có bệnh thận, vì vậy sự vắng mặt của bệnh võng mạc cần xem lại tổn thương cầu thận khác (bệnh thận màng). Ngược lại, chỉ ~60% bệnh nhân bệnh thận do đái tháo đường typ 2 có bệnh võng mạc. Đặc điểm lâm sàng gồm protein niệu, tăng huyết áp tiến triển và suy thận tiến triển.
Thay đổi bệnh lý bao gồm xơ cứng màng, lan tỏa, và/hoặc xơ cứng cầu thận dạng nốt (Kimmelstiel-Wilson). Tuy nhiên, bệnh nhân hiếm khi làm sinh thiết thận; tới mức mà định lượng microalbumin niệu hàng năm là cách quản lý thường xuyên cho tất cả bệnh nhân đái tháo đường, bệnh sử tự nhiên là một phần quan trọng của chẩn đoán. Sự tiến triển từ microalbumin niệu (30–300 mg/24 giờ) đến que thử dương tính (>300 mg albumin niệu) và sau đó tiến đến rõ ràng và bệnh thận mạn. Tuy nhiên, protein niệu có thể khá thay đổi ở bệnh thận do đái tháo đường, nhiều như 25 g/24 giờ khi không có suy thận nặng hoặc giá trị khác với suy thận tiến triển và ổn định, protein niệu vừa phải.
Điều trị với thuốc ức chế men chuyển trì hoãn khởi phát của bệnh thận nói chung và bệnh thận gia đoạn cuối nói riêng ở bệnh nhân đái tháo đường typ 1 với microalbumin niệu và/hoặc giảm chức năng thận và nên được áp dụng cho mọi bệnh nhân không có chống chỉ định. Nếu có ho ở bệnh nhân điều trị ức chế men chuyển, một thuốc ức chế thụ thể angiotensin là lựa chọn tốt tiếp theo. Đái tháo đường typ 2 với microalbumin niệu hoặc protein niệu có thể được điều trị với ức chế men chuyển hoặc ức chế thụ thể angiotensin. Dù thiếu các nghiên cứu dài hạn, nhiều tác giả ủng hộ ức chế tổng hợp của hệ thống renin-angiotensin-aldosterone (RAAS), ví dụ ức chế thụ thể angiotensin, ức chế men chuyển, chẹn thụ thể mineralocorticoid, và/hoặc ức chế renin, dấu hiệu của bệnh dai dẳng là protein niệu. Tăng kali máu, tụt huyết áp, và/hoặc mức lọc cầu thận càng tồi tệ hơn có thể giới hạn điều trị đơn độc hoặc kết hợp với ức chế RAAS. Nếu tăng kali máu tiến triển và không thể kiểm soát với (1) tối ưu hóa kiểm soát đường huyết, (2) lợi tiểu quai (nếu những liệu pháp khác không hiệu quả), hoặc (3) điều trị nhiễm toan chuyển hóa (nếu có), sau đó kiểm soát huyết áp chặt chẽ với các thuốc thay thế được bảo đảm. Sự lượng giá hội chứng thận hư được nêu ở Bảng.
Bảng. LƯỢNG GIÁ HỘI CHỨNG THẬN HƯ
Mẫu nước tiểu ngẫu nhiên cho protein và creatinin
Albumin, cholesterol, bổ thể huyết thanh
Điện di protein nước tiểu
Loại trừ bệnh lupus ban đỏ hệ thống, đái tháo đường
Xem lại thuốc đã dùng
Sinh thiết thận
Xem xét bệnh ác tính (ở người già với viêm cầu thận màng hoặc bệnh thay đổi tối thiểu)
Xem xét huyết khối tĩnh mạch thận (nếu có viêm cầu thận màng hoặc có triệu chứng của thuyên tắc phổi)
Bảng. NGUYÊN NHÂN CẦU THẬN CỦA BẤT THƯỜNG KHÔNG TRIỆU CHỨNG HỆ TIẾT NIỆU
I. Đái máu có hoặc không protein niệu
A. Các bệnh cầu thận nguyên phát
1. Bệnh Berger (Bệnh thận IgA)a
2. Viêm cầu thận màng tăng sinh
3. Đái máu do bệnh cầu thận nguyên phát khác đi kèm tăng sinh màng đơn thuần, viêm cầu thận tăng sinh khu trú và từng đoạn, hoặc các tổn thương khác.
4. Bệnh màng đáy mỏng (hình thái không điển hình của hội chứng Alport)
B. Liên quan đến bệnh hệ thống hoặc bệnh di truyền
1. Hội chứng Alport và bệnh đái máu lành tính có tính chất gia đình
2. Bệnh Fabry
3. Bệnh hồng cầu hình liềm
C. Liên quan đến nhiễm trùng
1. Viêm cầu thận sau nhiễm liên cầu đang thoái triển
2. Viêm cầu thận sau nhiễm trùng khác
II. Protein niệu không chỉ do thận hư
A. Các bệnh cầu thận nguyên phát
1. Albumin niệu thế đứng
2. Xơ cứng cầu thận khu trú và từng đoạn
3. Viêm cầu thận màng
B. Liên quan đến bệnh hệ thống hoặc bệnh di truyền
1. Đái tháo đường
2. Bệnh Amyloid
3. Hội chứng Nail-patella
aHay gặp nhất.
Bảng. KẾT QUẢ XÉT NGHIỆM HUYẾT THANH TRONG BỆNH HỆ THỐNG GÂY BỆNH CẦU THẬN
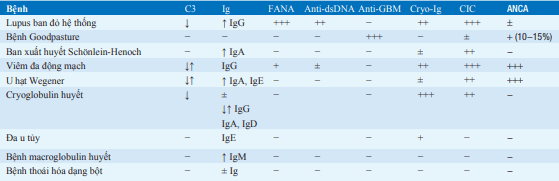
Các từ viết tắt: ANCA: kháng thể kháng bạch cầu đa nhân; anti-dsDNA: kháng thể kháng ADN; anti-GBM: kháng thể kháng màng đáy cầu thận; CIC: phức hợp miễn dịch lưu hành; cryo-Ig, tủa lạnh globulin miễn dịch; C3: thành phần bổ thể 3; FANA: xét nghiệm tìm kháng thể kháng nhân bằng huỳnh quang; Ig: globulin miễn dịch ; −: bình thường ; +: thỉnh thoảng có bất thường nh ẹ; ++: thường bất thường ; +++: bất thường nặng.
