Mục lục
MỞ ĐẦU
Rõ ràng là tăng trưởng khối u phụ thuộc vào sự tạo mạch, một quá trình phát triển liên tục các tế bào nội mô từ các mạch máu đã sẵn có từ trước. In situ, các khối u có đường kính nhỏ hơn 3 mm tồn tại ở trạng thái tiền huyết quản (prevascular state) bị hạn chế khả năng tăng trưởng (với điều kiện không cần tưới máu từ nguồn cung cấp). Không giống như quá trình tân huyết quản hóa, các khối u đang “im lìm” này vẫn ở kích cỡ hiển vi và nằm yên lặng trong nhiều năm. Khi tăng thêm các mạch máu mới sẽ làm tăng khả năng cung ứng oxy và các chất chuyển hóa cho các khối u và loại đi các chất thải loại. Tuy nhiên, những mạch máu mới được tạo thành này sẽ tạo thuận lợi cho sự tẩu thoát của các tế bào khối u tới những vùng xa hơn của cơ thể, ở đó có thể phát hiện được sự hình thành các di căn. Bằng chứng cho thấy những mạch máu mới phát triển từ các tế bào tiền thân nội mô có nguồn gốc từ tủy xương cũng góp phần vào việc làm tăng trưởng các mạch máu của khối u. Vì thế, ức chế sự tạo mạch khối u là một trị liệu tiềm năng quan trọng đối với tất cả các dạng ác tính, kể cả các khối u đặc và tủy xương (với các bệnh ác tính về máu). Việc ức chế hay kìm hãm chỉ một mao mạch đơn lẻ cũng đụng chạm tới sự tăng trưởng của nhiều tế bào khối u. Các kiểu trị liệu được thiết kế nhằm ức chế sự hình thành các mạch máu mới có lợi thế là nó nhắm vào các tế bào nội mô ổn định về mặt di truyền đang hỗ trợ cho sự tăng trưởng khối u và ít khả năng kháng lại cách trị liệu kháng sự tạo mạch. Trái lại, các hóa trị liệu chuẩn hiện nay lại được thiết kế nhằm tấn công các tế bào khối u không ổn định về mặt di truyền, do vậy mà có thể dẫn đến việc kháng lại nhanh chóng các tác nhân trị liệu hóa học.
Tạo mạch là một quá trình gồm nhiều bước và rất phức tạp, nó liên quan đến các quá trình sinh lý học bình thường ở người trưởng thành bao hàm cả hệ thống sinh sản của phụ nữ và sự làm lành vết thương. Ngoài việc làm cho các khối u tăng trưởng, sự tạo mạch mới còn giữ vai trò quan trọng trong nhiều quá trình bệnh lý bao gồm viêm khớp, lạc nội mạc tử cung, bệnh võng mạc do đái tháo đường và thoái hóa cơ.
Quá trình tạo mạch đã được mô tả rất kỹ trong nhiều tài liệu. Các tế bào nội mô trong các mao mạch hoặc tiểu tĩnh mạch dưới mao mạch nhận các kích thích tiền tạo mạch từ các yếu tố tăng trưởng hòa tan bao gồm yếu tố tăng trưởng nội mô huyết quản (vascular endothelial growth factor – VEGF) và yếu tố tăng trưởng nguyên bào sợi cơ bản (basic fibroblast growth factor – bFGF) với phương thức cận tiết (paracrine) từ các tế bào khối u bao quanh hoặc các tế bào mô đệm và khoang ngoại bào. Sự thoái hóa màng cơ bản do serin protease như plasmin và metalloproteinase gian bào (matrix metalloproteinases – MMP) sau khi hoạt hóa tế bào nội mô cho phép các tế bào này rời khỏi mạch máu đã được thiết lập để hướng tới kích thích sự tạo mạch. Những tế bào nội mô đang yên lặng một cách bình thường trở nên tăng sinh nhanh chóng theo hướng phát triển chồi (mầm) mao mạch. Các tế bào nội mô đâm mầm sẽ tạo nên các ống và nối với các mạch máu khác cho phép máu lưu thông. Các mao mach nguyên thủy này chưa hỗ trợ các tế bào quanh mạch nhưng đã bắt đầu có biểu hiện về sự hình thành màng cơ bản.
Hoạt hóa receptor angiopoietin 1/Tie 2 (tyrosin kinase 2) sẽ khởi đầu sự yên lặng nội mô, sự trưởng thành của mạch với sự hoàn tất màng cơ bản và tăng các tế bào trung mô và dần trở thành các tế bào quanh mạch (pericyte). Không giống như sự tạo mạch sinh lý học ở mô bình thường, các mạch máu của khối u không trải qua quá trình sinh trưởng theo kiểu này. Những mạch máu này vẫn ở trạng thái chưa trưởng thành và bị rò rỉ là do tác động của angiopoietin 2 – một kháng chủ vận đối với angiopoietn 1, tạo tín hiệu không ổn định đối với mạch máu, thúc đẩy sự sửa đổi huyết quản bổ sung khi có sự hiện diện của các yếu tố tăng trưởng tạo mạch.
Tân huyết quản hóa khối u không đơn giản là phát sinh từ việc biểu hiện quá mức các yếu tố tăng trưởng tạo mạch. Folkman và Hanahan đề xuất vấn đề về hiện diện của “sự chuyển đổi tạo mạch” (angiogenic switch) để mô tả sự chuyển dịch trong cân bằng giữa các yếu tố dương và âm kiểm soát tăng trưởng, tăng sinh của nội mô và sự hình thành huyết quản trong khối u.
Sự điều hòa gen thông qua việc biểu hiện thấp đi các yếu tố điều hòa âm sự tạo mạch cũng góp phần vào việc phát triển kiểu hình tạo mạch (Hình 11.1).
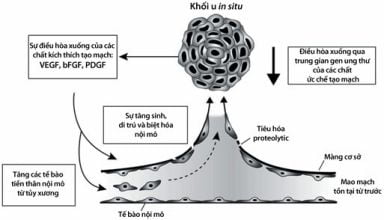
Hình 11.1. Cơ chế tạo mạch của khối u. Các yếu tố tiền tạo mạch được tạo ra bởi các tế bào khối u, bao gồm yếu tố tăng trưởng nội mô huyết quản (VEGF) kích thích tế bào nội mô yên lặng cạnh các mao mạch đã có từ trước. Các tế bào nội mô hoạt hóa sẽ tăng sinh và tiết ra các enzym proteolytic làm thoái hóa các chất ở ngoại bào, cho phép các tế bào di cư tới khối u. Các tế bào đang di cư tạo màng cơ bản dọc theo mạch máu mới được mọc ra. Hơn nữa, các tế bào tiền thân nội mô cũng có thể được tuyển mộ từ tủy xương sẽ đi vào các mao mạch mới được tạo thành. Sự ổn định hóa của mạch là do số lượng các tế bào bao quanh, nó được thu hút bởi yếu tố tăng trưởng có nguồn gốc từ tiểu cầu (platelet-derived growth factor -PDGF) giải phóng bởi các tế bào nội mô.
(Theo Steve Gyorffy, Jack Gauldie, A. Keith Stewart và Xiao-Yan Wen. (2005) Cancer Gene Therapy. Human Press. Totowwa, New Jersey)
Ngoài các yếu tố tăng trưởng tạo mạch như VEGF và bFGF, trên 28 chất trung gian (mediator) của sự tạo mạch đã được xác định. Trái ngược với các yếu tố này là trên 50 chất ức chế tạo mạch nội sinh cũng đã được biết đến. Nhiều trong số các chất ức chế này là các đoạn proteolytic của các đại phân tử đã được xác định là có hoạt tính kháng tạo mạch, bao gồm: angiostatin, endostatin, canstatin, vasostatin và 2 peptid mới được xác định là tumstatin và endorepellin.
Trong các mô hình tiền lâm sàng trên chuột, khi phân phối toàn hệ thống các chất ức chế tạo mạch là các protein tái tổ hợp đã làm thu nhỏ các khối u. Tuy nhiên, ngoại trừ các cytokin kháng tạo mạch, các chất ức chế angiostatin và endostatin lại rất an toàn, trong thời gian phân phối kéo dài không có phản ứng phụ nào xảy ra. Điều này có thể do tính đặc hiệu của các chất ức chế đối với tế bào nội mô góp phần vào việc tạo mạch khối u. Các nghiên cứu trên động vật chỉ rõ các protein kháng tạo mạch tái tổ hợp có thể được phân phối lặp đi lặp lại nhiều lần ở liều lượng cao sẽ làm nhỏ lại các khối u. Những protein tái tổ hợp này rất khó sản xuất và tinh chế với lượng lớn để có thể sử dụng được trong thực hành lâm sàng. Các protein tái tổ hợp cũng không ổn định và đời sống bán phần trong huyết tương ngắn do có sự biến đổi glycosyl hóa. Với việc đầu tư kỹ thuật và tài chính cho sản xuất các chất ức chế tạo mạch tái tổ hợp nội sinh cho ứng dụng trong lâm sàng thì gen trị liệu có thể duy trì các mức protein lưu hành sản xuất trực tiếp từ các tế bào của bệnh nhân đã được xử lý với các vec tơ.
CÁC CHIẾN LƯỢC GEN TRỊ LIỆU KHÁNG SỰ TẠO MẠCH
Hai chiến lược gen trị liệu đã được đề xuất để chuyển giao các protein kháng tạo mạch. Chiến lược thứ nhất liên quan tới gen trị liệu hệ thống, theo đó các vectơ được tiêm vào các bệnh nhân để tạo nên chất ức chế tạo mạch lưu thông ở nồng độ cao. Lý do là trong các mô hình tiền lâm sàng trên chuột và các TNLS pha I gần đây không thấy có độc tố tế bào khi sử dụng protein angiostatin hoặc endostatin. Tuy nhiên, độc tế bào do việc phân phối toàn hệ thống các vec tơ vẫn có thể là hiệu ứng phụ tiềm ẩn, đặc biệt là khi sử dụng các vec tơ virus.
Chiến lược thứ hai là gen trị liệu kháng tạo mạch được hướng bởi khối u nhằm tăng mức các protein kháng tạo mạch trong môi trường khối u. Cách tiếp cận này nhằm duy trì các protein ở mức cao trong khối u và có thể hạn chế được độc tế bào cho cả hệ thống do đặc tính sinh học của protein hoặc vec tơ. Tuy nhiên, những giới hạn tiềm tàng vẫn có thể xảy ra với cách tiếp cận này, đặc biệt khi điều trị các khối u mà chưa thể áp dụng được bằng chuyển giao vec tơ hoặc khi xử lý các di căn.
Với các trị liệu kháng tạo mạch khác bao gồm protein tái tổ hợp, kháng thể đơn dòng hoặc các chất ức chế chuyển tải tín hiệu có trọng lượng phân tử nhỏ, các gen chuyển tiềm năng,… đều là các thể loại chất ức chế “trực tiếp” hay “gián tiếp” kháng tạo mạch. Các chất ức chế trực tiếp nhắm đặc hiệu vào các tế bào nội mô trong khối u, còn cách tiếp cận gián tiếp lại nhắm vào khả năng của các tế bào khối u hoặc các tế bào người ngoài cuộc sản sinh ra các yếu tố tăng trưởng tạo mạch như VEGF và bFGF. Những yếu tố này làm phức tạp thêm cho các phương pháp gen trị liệu kháng tạo mạch sẽ được áp dụng đối với các dạng khối u khác nhau. Mặc dầu việc ức chế sự tân huyết quản hóa được nhận thức là một trị liệu khá phổ biến đối với ung thư, nhưng trong thực tế thì thành công của gen trị liệu kháng tạo mạch còn phụ thuộc vào khả năng tối ưu hóa hệ thống vec tơ với một gen chuyển phù hợp và có thể đặc hiệu cho một dạng khối u.
Gen trị liệu kháng tạo mạch đang sử dụng các sinh phẩm không virus như plasmid hoặc DNA trần cũng như các chiến lược có liên quan tới các virus như adenovirus, virus adeno liên hợp, retrooncovirus, lentivirus đã được sử dụng trong nhiều mô hình khối u loài gặm nhấm (Bảng 11.1). Phần lớn các cách tiếp cận này đều sử dụng các gen chuyển trực tiếp gây độc tế bào tới các tế bào nội mô khối u như angiostatin và endostatin. Những cách tiếp cận khác nhằm kiểm soát ức chế các yếu tố tăng trưởng tiền tạo mạch cũng như các quá trình nới rộng bằng việc nhắm tới các con đường MMP hoặc serin protease.
GEN TRỊ LIỆU CƠ SỞ TẾ BÀO VÀ PLASMID
Gen trị liệu dựa trên cơ sở plasmid DNA được đóng gói bằng các chất dẻo biểu hiện endostatin người đã có hiệu ứng làm chậm sự tăng trưởng Renca dưới da và ung thư phổi Lewis (Lewis lung carcinoma – LLC) trên chuột. Công trình này đã chứng minh rằng khi tiêm vào trong cơ một phức hợp plasmid – polymer sẽ duy trì được mức endostatin lưu thông có thể phát hiện được ở chuột sau 14 ngày xử lý. Một mô hình di căn phổi trên chuột được xử lý sơ bộ bằng việc tiêm plasmid vào cơ, sau một tuần tiêm lại đã làm giảm đáng kể các hạch u phổi. Những kết quả của nghiên cứu này đã chứng minh tính khả thi của việc tiêm lặp lại các phức hợp plasmid nhằm cảm ứng vừa phải sự ức chế tăng trưởng của khối u mà không làm phát triển các ĐUMD đối với vec tơ. Vì không có ĐUMD lại an toàn và pha chế tương đối dễ dàng nên phức hợp plasmid – polymer dùng cho việc chuyển giao là những đặc tính hấp dẫn của hệ thống này.
Tiêm cục bộ các vec tơ plasmid – polymer biểu hiện angiostatin hoặc endostatin sẽ làm giảm sự tăng trưởng khối u lần lượt là 36 và 49%, sau 3 lần tiêm trong khối u trong mô hình ung thư vú.
Trong một công trình được tiến hành song song, phức hợp plasmid – polymer biểu hiện endostatin được phân phối toàn hệ thống qua tĩnh mạch đã làm giảm kích cỡ khối u 40% so với đối chứng.
Trong mô hình ung thư vú ở chuột chuyển gen, các gen ung thư HER/neu được điều khiển bởi promoter virus khối u vú của chuột (murine mammary tumor virus – MMTV), một vec tơ plasmid-lisosom biểu hiện angiostatin được tiêm vào tuyến vú chuột trước khi phát hiện có các khối u hình thành. Chuột được nhận gen angiostatin đã giảm đáng kể cả về số lượng và kích cỡ khối u so với đối chứng. Không còn các di căn phổi trong các chuột đã được xử lý, điều đó chứng tỏ rằng có cả hiệu ứng hệ thống và hiệu ứng cục bộ trong trị liệu kháng tạo mạch.
Cấy ghép các tế bào thâm chuyển ex vivo có các plasmid mang DNA bổ cứu của angiostatin hoặc endostatin đã làm ức chế sự tăng trưởng khối u một cách cục bộ cũng như hệ thống. Thâm chuyển một khối u ác tính của mô liên kết có nguồn gốc từ nguyên bào sợi (sarcoma sợi) T241 của chuột tạo mạch cao với angiostatin đã kiềm chế sự tăng trưởng khối u nguyên phát và có thể ức chế sự phát triển của các di căn nhỏ ở phổi chuột. Khi tiêm dưới da các tế bào thận chuột hamster sơ sinh đã được thâm chuyển với andostatin ở dạng vi đóng gói là các hạt alginat – poly – L- lysin đã làm ức chế sự tăng trưởng của u nguyên bào đệm người ở mô hình chuột nude. Khi tiêm dưới da đơn 2×105 tế bào công nghệ hóa đã tiết ra liên tục endostatin và ức chế tăng trưởng khối u tới 62% trên 3 tuần.
Trong mô hình ung thư não, plasmid của endostatin đã đóng gói thâm chuyển 293 tế bào được cấy vào não đã làm giảm sự hình thành các mạch máu của khối u, tăng sống sót của động vật tới 85%. Các tế bào cấy ghép có thể biến đổi và tiết ra endostatin trong 4 tháng. Sự biểu hiện dài hạn và phát triển ĐUMD kháng lại các TB được đóng gói ở mức cực tiểu là các đặc tính hấp dẫn đối với các tiến trình gen trị liệu kháng sự tạo mạch.
Các tế bào gốc hay các tế bào tiền thân nội mô đã được chỉ rõ là rất quan trọng trong sự tân huyết quản hóa khối u. Có khả năng những TB tải nạp với các gen kháng sự tạo mạch này là các phương tiện chuyển giao quan trọng, nó có thể được tiêm vào toàn hệ thống, nhưng tốt nhất là tới những vùng có tăng trưởng khối u. Trị liệu tế bào theo kiểu này có thể được thực hành với các tế bào tiền thân nội mô tự thân được phân lập từ tủy xương của bệnh nhân hoặc trực tiếp từ máu.
Bảng 11.1. Những ví dụ về gen trị liệu kháng tạo mạch ở các mô hình ung thư loài gặm nhấm
Vec tơ Gen
Plasmid Endoststin
Angiostatin
Các TB thâm chuyển bởi plasmid Endoststin, angioststin Endostatin Throbospondin
Tế bào gốc tiền thân nội mô VEGFR2 (Flk-1) hòa tan
Adenovirus Angiostatin
IL-12
Endostatin
VEGFR1 (Flt-1) hòa tan VEGFR2 (Flk-1) hòa tan TIE- 2
TIMP
Virus adeno liên hợp VEGF antisense Angiostatin
VEGFR1 (Flt—1) hòa tan
Lentivirus/các tế bào gốc (Tie2/Tek promoter/thymidine kinase Virus gây bệnh bạch cầu chuột Moloney Endostatin, angiostatin
Yếu tố tiểu cầu 4 (PF4) Flk-1 âm tính ưu thế
Một cách tiếp cận ex vivo khác đã sử dụng những “nhà máy” tế bào trên giàn cấy ghép. Những cấy ghép trong màng bụng các phiến polyglycolic acid dễ phân hủy được gieo với các nguyên bào sợi NIH3T3 có retrovirus biểu hiện throbospondin-2 đã chứng minh có sự ức chế tạo mạch và tăng trưởng khối u trong ung thư tế bào vảy, u hắc sắc tố và các mô hình ghép ex vivo các TB thâm chuyển trong các nghiên cứu trên người nhằm ức chế tân huyết quản hóa khối u. Điều này còn phụ thuộc vào việc phát hiện các tế bào thích hợp để có thể cấy ghép an toàn vào trong vật chủ.
Một chiến lược đích mới sử dụng các hạt nano cũng đã được báo cáo. Hood và cộng sự đã phát triển hạt nano cationic gắn với ligand hữu cơ phân tử nhỏ nhắm tới integrin αv β3 của nội mô tạo mạch. Chuyển giao qua tĩnh mạch αv β3 ligand –NP cộng hợp với phân tử truyền tín hiệu Raf đột biến không có khả năng gắn với adenosin triphosphat đã làm ngăn chặn con đường tín hiệu nội mô và sự tạo mạch, dẫn đến apoptosis các tế bào nội mô có liên quan khối u và cảm ứng sự thu nhỏ của các khối u tiên phát cũng như các khối u đã di căn. Sử dụng các hạt nano cũng có thể cho những lợi thế vượt trội các vec tơ virus bởi vì chúng không sinh miễn dịch và có thể áp dụng lặp lại với các liệu trình điều trị kéo dài dai dẳng các khối u và các di căn.
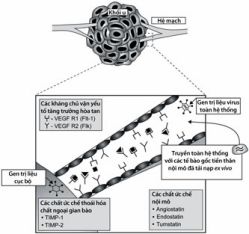
Hình 11.2. Các phương thức ức chế bởi gen trị liệu kháng tạo mạch trực tiếp. Gen trị liệu kháng sự tạo mạch nhắm tới các tế bào nội mô khối u đang hoạt động. Các vec tơ có thể được tiêm trực tiếp vào khối u hoặc chuyển giao toàn hệ thống qua hệ tuần hoàn. Các tế bào tiền thân nội mô tải nạp ex vivo được tiêm tĩnh mạch sẽ tới các vị trí tạo mạch, tạo nên việc sản xuất cục bộ các chất ức chế tạo mạch. Sự ức chế tăng trưởng mạch mới được hoàn tất với việc các gen chuyển biểu hiện được các chất ức chế tế bào nội mô, ngăn chặn các yếu tố tăng trưởng nội mô tiền tạo mạch và làm trở ngại sự phân giải chất ngoại gian bào.
(Theo Steve Gyorffy, Jack Gauldie, A. Keith Stewart và Xiao-Yan Wen. (2005) Cancer Gene Therapy. Human Press. Totowwa, New Jersey)
Chuyển giao các chất ức chế tạo mạch bởi các adenovirus
Các vec tơ adenovirus thế hệ đầu tiên khiếm khuyết sao chép đã được sử dụng chủ yếu trong các nghiên cứu gen trị liệu kháng tạo mạch. Những vec tơ này có rất nhiều lợi thế cho gen trị liệu như khả năng thâm nhiễm được các tế bào đang sao chép cũng như không sao chép, biểu hiện gen nhất thời cao, không gắn với các nguy cơ cho người và có khả năng sản xuất được virus độ chuẩn cao. Tuy nhiên, việc áp dụng các vec tơ này vẫn bị hạn chế vì túc chủ phát triển các ĐUMD thể dịch và tế bào ngay sau khi tiếp nhận vec tơ lần đầu tiên.
Một vec tơ adenovirus typ 5 biểu hiện angiostatin chuột (Ad-angiostatin) đã được mô tả. Vec tơ này được chỉ rõ là in vitro có hiệu ứng ức chế tăng trưởng các tế bào nội mô nuôi cấy và tân huyết quản hóa trong mô hình matrigel tạo mạch được điều khiển bởi bFGF. Bổ sung thêm 109 pfu virus đã tạo được apoptosis cho các tế
bào nội mô đang di cư trong nút matrigel (matrigel lug) 1 tuần sau cấy ghép dưới da. Trong mô hình ung thư vú di căn phổi đã làm giảm đáng kể những gánh nặng về khối u và làm chậm lại sự xuất hiện của các hạch khối u có thể nhìn thấy được. Sự biểu hiện quá mức cục bộ 5-10 ngày nhờ việc tiêm trực tiếp Ad-angiostatin vào chuột chuyển gen mang khối u vú do cấy ghép gen chuyển đã làm chậm lại sự tăng trưởng khối u và tăng sự sống sót của chuột đã được xử lý 3 tuần so với các đối chứng. Mật độ vi mạch máu xác định được bằng nhuộm CD31 thấy giảm đáng kể, trong khi đó hoại tử và apoptosis lại tăng lên trong các khối u đã được xử lý với angiostatin.
Những kết quả tương tự cũng phát hiện thấy khi sử dụng cytokin kháng tạo mạch tiềm năng interleukin -12 (IL-12) biểu hiện cục bộ tại khối u. Động học của sự tăng trưởng khối u trong 2 tuần khởi đầu tương tự như các khối u được xử lý với Ad- angiostatin hoặc Ad-IL-12. Không giống như chuột được xử lý với angiostatin, có ít phần trăm chuột xử lý với IL-12 tiếp tục thoái lui hoàn toàn khối khu. Những sự thoái lui này là nhờ khả năng kích thích miễn dịch của cytokin mà tạo nên ĐUMD đặc hiệu tế bào T. Những kết quả từ các mô hình ung thư vú tiên phát và di căn đã chứng minh rằng mặc dầu sự biểu hiện của angiostatin có thể làm chậm đi sự tăng trưởng khối u, nhưng nó chưa đủ để cảm ứng thoái lui hoàn toàn khối u đã được thiết lập. Tổ hợp angiostatin với IL-12 sẽ làm giảm tiềm năng hơn mật độ các vi mạch máu và ức chế sự tăng trưởng khối u. Những chuột được xử lý với trị liệu tổ hợp này đã tăng đáng kể tổi thọ và nói chung có thoái lui khối u.
Những chuột được xử lý với Ad-angiostatin được phân phối qua mũi hoặc trong màng bụng hay đưa thẳng vào khối u đều tăng trọng tới 30%. Tác dụng phụ này xảy ra trong vòng 2 tuần khi phân phối vec tơ cho cả chuột cái FVB và chuột C57Bl/6. Kiểm tra những chuột này thấy có suy giảm chức năng buồng trứng và giảm mức estradiol và progesteron giống như sự khởi đầu của thời kỳ mãn kinh.
Những dẫn liệu này đã khẳng định chắc chắn rằng các angiostatin lưu thông ở mức cao có tác động tới sự tạo mạch sinh lý học bình thường của hệ sinh sản của nữ giới. Những kết quả này chỉ rõ rằng việc theo dõi cẩn thận các bệnh nhân nữ đang ở tuối sinh đẻ mà lại tiến hành gen trị liệu kháng tạo mạch là một đòi hỏi cần thiết.
Nhiều nhóm nghiên cứu đã báo cáo về hiệu lực chuyển gen endostatin của adenovirus trong nhiều mô hình khối u. Những kết quả của Wen và cộng sự chỉ rõ việc phân phối toàn hệ thống vec tơ qua tĩnh mạch sẽ có protein endostatin lưu thông ở mức cao trên 2 tháng trong chuột 129/J. Trái lại, chuột Balb/c khi nhận một lượng vec tơ giống hệt lại có mức endostatin thấp hơn nhiều và chỉ biểu hiện trong thời gian ngắn. Trong mô hình u phổi di căn, khi phân phối vec tơ toàn hệ thống đã làm giảm đáng kể di căn EOMA so với chuột được xử lý với vec tơ đối chứng. Tuy nhiên, không thấy giảm tăng trưởng u sắc tố đã di căn ở B18 khi sử dụng liều virus tương tự như ở chuột C57Bl/6.
Trong mô hình di căn gan từ trực kết tràng, gen trị liệu endostatin adenovirus đã bảo vệ 25% chuột không phát triển các tổn thương di căn. Nghiên cứu này đã tận dụng tính hướng gan của vec tơ adenovirus nhằm tạo nên một môi trường tạo mạch nghèo nàn cho việc phát triển các di căn kết tràng. Phân phối trước các vec tơ adenovirus cũng có hiệu ứng ức chế phát triển khối u trong mô hình ung thư vú ở chuột chuyển gen. Sự tạo mạch thông qua việc phân phối toàn hệ thống vec tơ có thể làm chậm lại sự chuyển đổi từ tổn thương vú xâm lấn tới ung thư xâm lấn.
Gen trị liệu adenovirus sử dụng receptor kháng chủ vận nhắm vào các yếu tố tăng trưởng tạo mạch đã được báo cáo là có hiệu quả. Các vec tơ biểu hiện các receptor hòa tan của VEGF đã chứng minh là những kết quả hứa hẹn trong các mô hình động vật. Tiêm trong cơ vec tơ sản xuất VEGFR1 hòa tan (Flt-1 [ Fms-like tyrosine kinase) hòa với phần Fc của IgG có thể ức chế sự tăng trưởng khối u phổi tiết VEGF ở mức cao. Các kháng chủ vận VEGF lưu thông có thể phát hiện được trong 21 ngày và không phát hiện thấy độc tố tế bào nào đối với động vật. Flt-1 dạng hòa tan cũng có hiệu ứng làm giảm sự tăng trưởng của u nguyên bào sợi T241 và LLC khi tiêm vec tơ qua đường tĩnh mạch. Báo cáo này cũng chứng minh được hiệu quả của vec tơ adeno sản xuất ra VEGFR2 hòa tan (Flk-Fc [ fatal liver kinase- Fc]) để ức chế sự tăng trưởng khối u đại tràng trong chuột SCID.
Những kết quả này đã chứng minh hiệu quả của receptor VEGF trong việc ức chế tăng trưởng các dạng khối u khác nhau. Tuy nhiên, vẫn chưa giải thích được độc tính gây nên bệnh cổ trướng sau khi sử dụng vec tơ Flt-1.
Adenovirus biểu hiện Tie 2 hòa tan đã ức chế sự tăng trưởng của các khối u tiên phát và đã di căn. Lin và cộng sự đã chứng minh rằng khi chuyển giao toàn hệ thống thì vec tơ này tác động với phương thức bắt chước tác động của angiopoietin 2, bao gồm sự tan dã mạch máu dẫn đến việc thu nhỏ các mạch máu của khối u.
Người ta đã nghiên cứu việc chuyển giao các chất ức chế mô metalloproteinase (tissue inhibitor of metalloproteinase- TIMP) – kháng chủ vận tự nhiên của MMP đối với việc ức chế xâm lấn và sự tạo mạch của tế bào khối u. Các vec tơ biểu hiện TIMP1 hoặc TIMP2 đã ức chế sự xâm lấn của khối u đối với các tế bào ung thư trong tụy tạng ở chuột khi adenovirus được phân phối sớm vào các khối u đang phát triển. Tiêm trực tiếp một vec tơ biểu hiện Ad-TIMP2 sẽ rất hiệu lực đối với việc ức chế tăng trưởng LLC sơ cấp cũng như làm giảm số lượng di căn phổi.
Giảm đáng kể mật độ vi mạch máu cũng quan sát thấy nhờ nhuộm WF. Tuy nhiên, ích lợi về thời gian sống sót nói chung chỉ là 12 ngày so với các động vật đối chứng.
Những nhược điểm của sự chuyển gen adenovirus hiện nay nhằm ức chế sự tạo mạch đã được loại bớt đi rất nhiều ở vec tơ thế hệ thứ 3 – đó là các adenovirus “phụ thuộc helper”. Park và cộng sự đã phát triển hệ thống vec tơ adenovirus phụ thuộc helper với việc loại bỏ toàn bộ các trình tự mã hóa của virus. Những vec tơ này sau này có thể được sử dụng để chuyên chở tới 33,6 kb DNA ngoại sinh. Tuy nhiên, vì những vec tơ này không biểu hiện protein virus nên đã làm giảm rất nhiều ĐUMD đối với túc chủ, dẫn đến biểu hiện kéo dài các gen chuyển, đó thật sự là lý tưởng đối với trị liệu kháng tạo mạch. Tuy nhiên, những ưu điểm của hệ thống này vẫn chưa được vận dụng trong bất cứ nghiên cứu tạo mạch nào in vitro cũng như in vivo.
Chuyển gen kháng tạo mạch bởi virus adeno liên hợp
Các virus adeno liên hợp tái tổ hợp (recombinant adeno-asociated virus –rAA) là các vec tơ khiếm khuyết sao chép, không gây bệnh thuộc nhóm parvovirus của người. Những vec tơ này có tiềm năng to lớn đối với gen trị liệu ung thư bởi vì chúng có thể tải nạp được cả những tế bào đang phân chia và không phân chia, tính sinh miễn dịch kém hơn các vec tơ khác và có thể hợp nhất được vào hệ gen của túc chủ, cho phép biểu hiện dài hạn các gen chuyển. Tuy nhiên, cũng như những hệ thống vec tơ tích hợp khác, những quan ngại về đột biến ghép tiềm tàng có thể làm hạn chế các ứng dụng của chúng.
Có vài bài báo về việc sử dụng những vec tơ này để chuyển giao các gen kháng tạo mạch trong trị liệu ung thư. Nguyen và cộng sự đã phát triển các vec tơ rAAV chứa các gen angiostatin, endostatin và mRNA antisense VEGF. Nghiên cứu này đã chứng minh được khả năng sản xuất các protein endostatin và angiostatin hoạt hóa và khả năng ức chế sản xuất VEGF từ các TB khối u nuôi cấy. Tuy nhiên, nghiên cứu này vẫn chưa mở rộng được tới các mô hình động vật.
Ma và cộng tác đã xử lý thành công các mô hình khối u não chuột khi tiêm vào hộp sọ hay trong cơ rAAV biểu hiện angiostatin.Thâm chuyển ổn định các tế bào u thần kinh đệm C6 với rAAV-angiostatin sau đó cho ghép nội sọ, kết quả là ức chế đáng kể sự tăng trưởng khối u. Các khối u đạt thể tích tối đa 2 tuần sau cấy ghép, nhưng lại thu hẹp lại đáng kể sau 5 tuần. Trái lại, các TB khối u tải nạp đối chứng thì đạt thể tích nguy hiểm tối đa trong vòng 3 tuần. Những sự thoái lui tương tự cũng quan sát được khi tiêm trực tiếp vec tơ vào các khối u não đã có từ trước. Khả năng sống sót cũng tăng đáng kể, 40% chuột được xử lý có sự phân bố mạch nhỏ và thưa thớt tại các khối u trong 6 tháng. Khả năng sống sót đã tăng tới 55% khi tiêm đồng thời với gen tự sát RSVtk. Độc tính liên quan tới việc xử lý tiếp theo với ganciclovir làm hạn chế khả năng sống sót cũng cao hơn. Trong một nghiên cứu tiếp theo, người ta tiêm đơn rAAV-angiostatin vào cơ chân chuột nude đã làm ức chế sự sinh huyết quản của khối u và làm tăng trưởng các tế bào U87 nội sọ. Mức angiostatin lưu thông cao đã làm tăng thời gian sống sót của nhóm điều trị, 40% chuột sống sót trên 10 tháng.
Biểu hiện dài hạn là lợi ích chính của các vec tơ rAAV. Khi tiêm vào tĩnh mạch cửa một vec tơ sản xuất Flk-1 hòa tan đã chứng minh được sự biểu hiện của protein từ gan trên 6 tháng. Điều này đã chỉ rõ có hiệu ứng trong việc làm giảm mật độ mạch máu của khối u cũng như kích cỡ khối u dưới da SK-NEP-1 trong các mô hình trên chuột.
Ức chế tân huyết quản hóa khối u bởi retrovirus
Gen trị liệu trung gian retrovirus đã được nhiều nhóm nghiên cứu sử dụng để chuyển giao các chất ức chế tạo mạch biểu hiện dài hạn trong các mô hình khối u. Đa số các nghiên cứu này đều sử dụng retrooncovirus bệnh bạch cầu chuột Moloney (Molooney murine leukemia – MmuLv). Các vec tơ lentivirus thế hệ thứ 3 khiếm khuyết sao chép dựa trên nền tảng virus gây thiếu hụt miễn dịch trên người đã được phát triển cho các ứng dụng kháng tạo mạch. Đây là một cố gắng để vượt qua các hạn chế về khả năng của các vec tơ MMuLv nhằm thâm nhiễm chỉ với các TB đang phân chia.
Chuyển giao tổ hợp angiostatin và endostatin bởi retrovirus đã chỉ rõ là có tác động đồng vận trong các mô hình trị liệu u sắc tố và bệnh bạch cầu. Chuột được cấy ghép các tế bào bệnh bạch cầu L1210 được tải nạp bởi MMuLv biểu hiện cả 2 chất ức chế tạo mạch, khả năng sống sót không u nói chung là 40%, trong khi đó lại không thấy các lợi thế sống sót đối với các nhóm TB chỉ tải nạp với angiostatin hoặc endostatin.
Các vec tơ retrovirus cũng được sử dụng trong các mô hình u thần kinh đệm loài gặm nhấm để chuyển giao yếu tố tiểu cầu 4 (PF4) và một Flk-1 âm tính trội (dominant negative Flk-1). Tanaka và cộng tác đã chứng minh rằng: 14 ngày sau cấy ghép các tế bào thần kinh đệm RT2 tải nạp với PF4 thì các khối u tạo ra vẫn còn nhỏ và giảm sự phân bố mạch máu. Trái lại các khối u đối chứng thì tăng cường huyết quản hóa và lớn hơn khá nhiều. Trong một nghiên cứu về u thần kinh đệm GS-9L của chuột, các TB tải nạp với Flk-1 âm tính trội, thiếu domain báo hiệu nội bào có thể ức chế được tăng trưởng khối u khi được tiêm vào não. Không thấy có sự thu nhỏ đáng kể khối u xảy ra khi dich nổi (supeRNAtant) có chứa virus được tiêm vào các khối u đã có từ trước, điều đó chứng tỏ hiệu ứng tải nạp của các vec tơ retrovirus in vivo còn rất nghèo nàn.
Mặc dù các nghiên cứu về retrovirus này là rất quan trọng trong việc chứng minh những hiệu ứng có lợi của việc biểu hiện chất ức chế tạo mạch dài hạn, tuy nhiên những áp dụng thực tế trong điều trị các khối u của người thì vẫn còn hạn chế.
KẾT LUẬN
Những nghiên cứu về sự tạo mạch là một lĩnh vực chỉ mới được thiết lập 30 năm nay. Trong thời kỳ này người ta đã chứng minh rõ rằng trong ung thư thì các khối u “hiếu chiến” đòi hỏi các mạch máu phải được phát triển để có thể di căn hóa sang các điểm xa hơn trong cơ thể. Điểm nổi bật ở thập kỷ trước là nhiều chất ức chế tạo mạch là các protein nội sinh hay các mảnh protein đã được phát hiện trong cơ thể. Hiện nay các TNLS đang khảo sát độ an toàn và hiệu lực của các chất ức chế này. Những protein tái tổ hợp này có những đặc tính rất đặc biệt và nhiều trở ngại đã được vượt qua trong việc tìm hiểu các cơ chế tác động, liều lượng sử dụng và các hiệu ứng sinh học trong lâm sàng.
Đã có bằng chứng cho thấy nhiều chất ức chế protein này có cấu trúc phức tạp và rất khó sản xuất với số lượng lớn để có thể sử dụng cho các bệnh nhân ung thư. Hy vọng rằng gen trị liệu sẽ làm giảm nhẹ các nhược điểm này bằng cách làm cho bệnh nhân có thể tạo được các chất ức chế một cách trực tiếp bằng chính các tế bào của mình.
Đối với các áp dụng khác của gen trị liệu ung thư thì trở ngại chính trong cách tiếp cận kháng tạo mạch là việc phát triển các vec tơ an toàn và thích hợp. Vec tơ gen trị liệu tối ưu cho trị liệu tạo mạch phải chuyển giao được một cách chắc chắn các gen chuyển trong nhiều giai đoạn. Hơn nữa, vec tơ phải an toàn và tính sinh miễn dịch thấp mới cho phép áp dụng được nhiều lần vì các bệnh nhân ung thư rất có thể phải duy trì các chất ức chế này trong nhiều tháng thì mới thiết lập được sự thoái lui bệnh tột bậc và ổn định. Sau chót là, vec tơ thích hợp được sử dụng có thể còn phụ thuộc vào các dạng ung thư và các đặc tính sinh học của gen chuyển kháng tạo mạch. Tuy vậy, cũng chẳng phải nghi ngờ gì nữa gen trị liệu kháng tạo mạch sẽ là một phương pháp điều trị có ý nghĩa đối với ung thư trong một tương lai gần.
