Giới thiệu
Viêm gan B là một trong những mầm bệnh hay gặp nhất trên thế giới. Tới 95% số người nhiễm HIV đã từng nhiễm viêm gan B và 10-15% mắc viêm gan B mạn tính, và con số thống kê thay đổi tùy từng vùng địa lý và nhóm nguy cơ. Ước tính có khoảng 100.000 bệnh nhân HIV ở Mỹ mắc viêm gan B mạn tính. Đường tình dục là đường lây hay gặp nhất. Khả năng lây qua đường máu cao hơn so với HIV: sau 1 lần bị kim đâm có dính máu nhiễm HBV, khả năng nhiễm virus là 30% (HCV là khoảng 2-8% và HIV khoảng 0,3%). Nhiễm HBV tiên phát dẫn tới viêm gan mạn tính ở 2-5% số người lớn có miễn dịch toàn vẹn, trong khi đó khả năng mạn tính ở bệnh nhân HIV cao gấp 5 lần. Lý do là HIV ức chế miễn dịch, trong khi các yếu tố của virus như mức độ virus huyết và kiểu gen lại không liên quan nhiều. Viêm gan B và HIV có một số đặc điểm chung, mặc dù viêm gan B là một virus DNA chuỗi kép. Sau khi xâm nhập tế bào gan, DNA của virus được tích hợp vào bộ gen của tế bào vật chủ. RNA của virus được dịch mã bằng men sao chép ngược của HBV để tạo ra DNA mới và protein của virus. Sự sao chép ngược có thể bị ức chế bởi các thuốc ức chế men sao chép ngược loại nucleoside hoặc nucleotide. Sự tích hợp của virus vào gen (tế bào gan và CD4) của vật chủ khiến không thể loại bỏ được virus.
Chẩn đoán HBV ở bệnh nhân HIV cũng tương tự như ở bệnh nhân không nhiễm HIV. Bảng 1 tổng kết cách phiên giải các kết quả huyết thanh. Sàng lọc HBV ở bệnh nhân nhiễm HIV thường bắt đầu bằng HBsAg, anti-HBs và anti-HBc. Nếu HBsAg (+), cần xét nghiệm HBeAg, anti-HBe và HBV DNA. Còn có tranh cãi về nhiễm trùng “ẩn” (occult) do “trốn tránh” miễn dịch, có nghĩa là bệnh nhân không có HBsAg nhưng HBV DNA (+). Các nghiên cứu gần đây không tìm thấy bằng chứng của các nhiễm virus “ẩn” này và tỷ lệ và tác động của hiện tượng này vẫn còn chưa rõ.
Bảng 1: Phiên giải kết quả xét nghiệm huyết thanh HBV
| Phiên giải | HBsAg | anti-HBs | anti-HBc | HBeAg | anti-HBe | HBV-DNA |
| Chưa bao giờ tiếp xúc với HBV | – | – | – | – | – | – |
| Nhiễm virus cấp tính | + | – | + (IgM) | + | – | + |
| Nhiễm virus từ trước và đã có miễn dịch | – | + | + (IgG) | – | + | – |
| Viêm gan B mạn | + | – | + (IgG) | + | – | + |
| Nhiễm virus “ẩn”1 | – | – | + (IgG) | – | – | + |
| Đột biến tiền nhân | + | – | + (IgG) | – | + | + |
| Người lành mang virus | + | – | + (IgG) | – | + | – |
| Miễn dịch sau tiêm chủng | – | + | – | – | – | – |
1 Còn tranh cãi.
Nói chung, bệnh nhân viêm gan B mạn tính cần được sàng lọc ung thư biểu mô tế bào gan mỗi 6-12 tháng. Alpha fetoprotein huyết thanh và siêu âm gan là các xét nghiệm cần làm. Khuyến cáo này không phụ thuộc tình trạng xơ gan do 10-30% số bệnh nhân ung thư không có xơ gan từ trước.
Diễn biến của viêm gan B ở bệnh nhân đồng nhiễm HIV
Ở bệnh nhân HIV, viêm gan B mạn tính có một diễn biến không thuận lợi khi so với bệnh nhân chỉ nhiễm HBV và nguy cơ tử vong do bệnh gan cao hơn rõ rệt (khoảng 15 lần). Khi tử vong do HIV giảm thì tử vong do bệnh gan lại tăng lên (Thio 2002, Konopnicki 2005). Ngoài việc làm tăng tỷ lệ tử vong, đồng nhiễm HIV còn thúc đẩy tiến triển của viêm gan B và tăng nguy cơ xơ gan. Mặc dù có bệnh cảnh tồi như vậy, ban đầu diễn biến lâm sàng của viêm gan B ở bệnh nhân HIV(+) lại nhẹ và lành tính hơn cho dù mức độ nhân bản của virus tăng. Điều này có vẻ vô lý nhưng có thể giải thích được bằng hiện tượng suy giảm miễn dịch tế bào, dẫn tới tăng nhân bản virus đồng thời làm giảm phá hủy tế bào gan. Vì vậy, transaminase ở bệnh nhân đồng nhiễm HBV/HIV thường chỉ tăng nhẹ. Ngược lại, HBV DNA lại cao hơn so với bệnh nhân miễn dịch toàn vẹn. Cho dù phản ứng viêm ít hơn, xơ gan lại thường gặp hơn.
Hiện tượng này cũng đã được mô tả ở quần thể bệnh nhân suy giảm miễn dịch do các căn nguyên khác (ví dụ ghép tạng…)
Có một tương quan trực tiếp giữa mức độ suy giảm miễn dịch và khả năng kiểm soát sự nhân bản của HBV: thậm chí ở những ca viêm gan đã khỏi (anti-HBe dương tính, HBV DNA âm tính), hiện tượng suy giảm miễn dịch có thể làm HBV tái hoạt động. Một số ca tái hoạt động của viêm gan B đã được mô tả sau khi có phục hồi miễn dịch do HAART.
Ngược lại với diễn biến không thuận lợi của viêm gan B, diễn biến của HIV lại không bị ảnh hưởng bởi đồng nhiễm viêm gan. Tuy nhiên, các độc tính gan do HAART (trị liệu kháng retrovirus hiệu lực cao) cũng tăng hơn 3 lần ở bệnh nhân viêm gan B mạn tính. Liệu tiên lượng của bệnh nhân đồng nhiễm HIV/HBV có thay đổi do HAART (trị liệu kháng retrovirus hiệu lực cao) và các biện pháp điều trị HBV hay không thì còn chưa rõ. Tỷ lệ tử vong do HBV có vẻ giảm đi nếu HBV được kiểm soát tốt (ví dụ French GERMIVIC-cohort).
Dự phòng
Mọi bệnh nhân HIV chưa nhiễm HBV (huyết thanh âm tính) nên được tiêm chủng. Tuy nhiên, vacxin có thể kém hiệu quả hơn do suy giảm miễn dịch. Khoảng 30% số bệnh nhân HIV không đáp ứng với vacxin (chỉ 2,5% bệnh nhân miễn dịch toàn vẹn có hiện tượng này). Hiện tượng này đặc biệt đúng ở bệnh nhân có CD4 dưới 500/µl khi tỷ lệ đáp ứng chỉ 33%. Do đó, liều vacxin thông thường có thể áp dụng cho bệnh nhân có CD4 > 500/µl (20 µg vào các tháng 0, 1, và 12), trong khi ở bệnh nhân có CD4 dưới 500/µl cần liệu trình tăng cường (20 µg vào các tháng 0, 1, 2, và liều cuối cùng khoảng giữa tháng 6 và 12). Trong trường hợp không đáp ứng (kiểm tra 12 tuần sau mỗi chu kỳ tiêm), cần lặp lại liệu trình vacxin với liều gấp đôi trong 4 bước (40 µg vào các tháng 0, 1, 2, và 6-12). Các bệnh nhân có CD4 dưới 200/µl và chưa điều trị HAART (trị liệu kháng retrovirus hiệu lực cao) cần được điều trị HAART (trị liệu kháng retrovirus hiệu lực cao) trước rồi mới tiêm phòng HBV.
Mất miễn dịch bảo vệ xuất hiện ở 30% số bệnh nhân mỗi năm sau khi đã chuyển đảo huyết thanh. Do đó, cần định lượng nồng độ anti-HBs hàng năm và cần tiêm liều nhắc lại khi anti- HBs dưới 100 IU/l. Bệnh nhân HIV nếu chưa có miễn dịch chống lại HBV cần được sàng lọc hàng năm để phát hiện tình trạng mới nhiễm virus. Bệnh nhân đồng nhiễm HIV/HBV và có huyết thanh viêm gan A âm tính cần được tiêm vacxin viêm gan A (tháng 0 và 6) do tỷ lệ viêm gan A ác tính tăng. Bệnh nhân có nguy cơ mắc cả 2 loại virus viêm gan A và B cần được tiêm vacxin kép (tháng 0, 1 và 6).
Sau khi được tiêm chủng, bệnh nhân cần được tư vấn về các cách phòng lây nhiễm và lây truyền các loại virus khác như viêm gan C (tình dục an toàn, tránh dùng chung kim tiêm…). Họ cần được giáo dục về các chiến lược phòng tránh sự tiến triển của bệnh gan như tránh uống rượu bia, hút thuốc lá (còn tranh cãi), hoặc các thuốc thảo dược (rất nhiều thuốc độc với gan). Việc sử dụng các thuốc gây độc gan (ví dụ thuốc lao) cần được tiến hành cẩn trọng.
Trẻ sơ sinh sinh ra từ các bà mẹ viêm gan B mạn tính cần được tiêm globulin miễn dịch chống viêm gan B và tiêm chủng chủ động.
Điều trị
Điều trị viêm gan B ở bệnh nhân đồng nhiễm là phức tạp bởi tình trạng suy giảm miễn dịch. Do HBV tồn tại trong tế bào nhiễm ngay cả sau khi đã điều trị thành công, việc loại bỏ hoàn toàn HBV là không thể với các biện pháp điều trị hiện tại. Tương tự như vậy, hình thành kháng thể bảo vệ anti-HBs và mất HBsAg là rất khó đạt được. Mục tiêu của điều trị cho tới nay vẫn là chuyển đảo huyết thanh từ HBeAg sang anti-HBe, ức chế hoàn toàn HBV DNA, men gan về bình thường, cải thiện mô học của gan và phòng ung thư biểu mô tế bào gan. Lợi ích khác của điều trị HBVlà giảm nguy cơ lây truyền bệnh và giảm nguy cơ độc gan do HAART.
Các thuốc có tác dụng kháng HBV
HBV có thể được điều trị bằng dẫn chất nucleoside, nucleotide và interferon (xem Bảng 2). Một số nucleos(t)ide cũng tác dụng với cả HIV. Do đó, trong đa số trường hợp thuốc HBV cũng nằm trong thành phần của phác đồ điều trị HIV, trừ phi bệnh nhân chưa cần điều trị HAART. 3TC, FTC, tenofovir và có lẽ entecavir đều có tác dụng với cả HIV và HBV. Adefovir và telbivudin chỉ tác dụng với HBV. Interferon gần như không quan trọng trong đồng nhiễm HBV/HIV cho dù ở bệnh nhân HBV đơn thuần, thuốc được coi là điều trị tiêu chuẩn.
Độ mạnh kháng virus được xếp hạng như sau (dựa vào mức giảm nhân bản HBV sau 1 năm): entecavir > telbivudin > tenofovir > 3TC > adefovir > FTC. Entecavir giảm nhân bản HBV khoảng 7 log, tenofovir khoảng 6 log, 3TC 5 log, và FTC 3 log. Các hướng dẫn điều trị hiện nay chưa tính đến sự khác biệt đó. Người ta chưa rõ liệu sự khác biệt đó có ý nghĩa gì trên lâm sàng hay không.
Kháng thuốc là một vấn đề đáng lo ngại. Điều trị 3TC đơn thuần sẽ chọn lọc đột biến ở YMDD-motif của gen polymerase ở 20% bệnh nhân mỗi năm (quá trình sinh HBeAg có thể dừng lại tương tự như đột biến tiền nhân). Có thể có kháng chéo giữa 3TC, FTC, entecavir và telbivudin, và tăng liều có thể giải quyết được một phần (ví dụ liều entecavir cần cao hơn nếu bệnh nhân đã điều trị 3TC trong quá khứ). Adefovir và tenofovir là các dẫn chất nucleotide với cơ chế kháng thuốc riêng nên vẫn còn hiệu quả sau khi các dẫn chất nucleoside khác đã thất bại. Tenofovir còn có tác dụng ngay cả khi adefovir đã thất bại.
Từ những bài học của HIV và tỷ lệ kháng lamivudine rất cao của HBV, việc phối hợp ít nhất 2 thuốc có lẽ quan trọng để tránh kháng thuốc. Các báo cáo ca bệnh chưa thấy đột biến xuất hiện nếu phối hợp một nucleoside và một nucleotide. Tuy vậy, chưa có bằng chứng khẳng định cách phối hợp này. Hiện nay, nếu có thể thì phối hợp một dẫn chất nucleoside và một dẫn chất nucleotide sẽ tốt hơn đơn trị liệu.
Thời gian điều trị bao nhiêu là tối ưu hiện chưa rõ. Do không thể loại bỏ hoàn toàn virus, có lẽ phải chấp nhận điều trị ức chế cả đời tương tự như HIV. Bệnh nhân đồng nhiễm HIV/HBV cũng cần điều trị HIV liên tục nên các thuốc có tác dụng với HBV sẽ được kết hợp vào HAART.
Bệnh cảnh lâm sàng viêm gan cấp có thể xảy ra nếu ngừng điều trị HBV. Thậm chí suy gan dẫn đến tử vong cũng có thể xảy ra. Mọi ngắt đoạn điều trị phải được cân nhắc kỹ ở bệnh nhân đồng nhiễm HBV/HIV. Khi thuốc đã không còn hiệu quả thì có thể ngừng mà không cần lưu ý gì đặc biệt. Hiện tượng suy sụp về lâm sàng sẽ không xảy ra.
Bệnh nhân suy thận cần chỉnh liều các dẫn chất nucleos(t)ide. Interferon có thể là lựa chọn hàng đầu cho một nhóm bệnh nhân nhất định. Đó là các bệnh nhân không cần điều trị HAART (trị liệu kháng retrovirus hiệu lực cao) và có các yếu tố dự báo đáp ứng tốt với interferon: CD4 cao, HBeAg dương tính, ALT tăng, HBV DNA thấp. Điều trị interferon bị hạn chế bởi độc tính (xem thêm chương viêm gan C và chương Thuốc). Chống chỉ định interferon ở những bệnh nhân bệnh gan mất bù. Ở bệnh nhân có bệnh gan nặng, cần sử dụng rất thận trọng.
Cuối cùng thì ghép gan vẫn là một lựa chọn cho các bệnh nhân xơ gan và/hoặc ung thư biểu mô tế bào gan.
Bảng 2: Các thuốc điều trị viêm gan B mạn tính ở bệnh nhân đồng nhiễm HIV/HBV.
| Thuốc | Liều | Thời gian điều trị |
| Adefovir | 10 mg mỗi ngày | Tối thiểu 12 tháng, có lẽ cả đời |
| Emtricitabine | 200 mg mỗi ngày | Chưa xác định |
| Entecavir | 0.5 mg, nếu chưa bao giờ điều trị 3TC, 1.0 mg, nếu đã từng điều trị 3TC | Chưa xác định |
| Lamivudine | 300 mg mỗi ngày1 | Tối thiểu12 tháng ở bệnh nhân HBeAg (+) và 6 tháng sau khi HBeAg chuyển đảo Vô hạn định ở bệnh nhân HBeAg âm tính |
| Telbivudine2 | 600 mg/ngày | Chưa xác định |
| Tenofovir | 300 mg mỗi ngày | Chưa xác định |
| Interferon-a | 5 MU /ngày hoặc 10 MU 3 ngày/tuần | 4-6 tháng ở bệnh nhân HBeAg (+) 12 tháng ở bệnh nhân HBeAg (-) |
| PEG-Interferon | Pegasys™ 180 µg tuần 1 lần PEG-Intron™ 1.5 µg/kg tuần 1 lần | Chỉ Pegasys™ được cấp phép ở bệnh nhân HBV đơn thuần. Thời gian điều trị là 12 tháng. |
1: Zeffix (3TC) liều thấp hơn không được dùng trong đồng nhiễm HIV/HBV
2: Telbivudin đã được cấp phép ở Mỹ từ 10/2006, đang chờ cấp phép ở châu Âu
Hướng dẫn điều trị
Về nguyên tắc, do đồng nhiễm gây tăng tỷ lệ tử vong và thúc đẩy tiến triển của bệnh, cần xem xét chỉ định điều trị cho mọi bệnh nhân. Nên điều trị nếu (Alberti 2005, Soriano 2005, Brook 2005):
- ALT liên tục > 2 lần bình thường (ALT trước điều trị cao thì đáp ứng với interferon và lamivudine càng tốt);
- HBeAg dương tính;
- HBV DNA > 20,000 IU/mL, nếu HBeAg(+); > 2,000 IU/mL, nếu HBeAg(-) (ngưỡng tối ưu chưa rõ, 20,000 IU tương đương 105 bản sao/ml tùy loại xét nghiệm)
- Phản ưng viêm hoặc xơ gan rõ trên tiêu bản sinh thiết
Hiện nay, chỉ định điều trị HBV dựa trên các chỉ số sinh hóa. Để đánh giá độ xơ gan một số phương pháp không xâm nhập đã được đưa ra. FibroscanTM đang được lưu tâm đặc biệt. Kỹ thuật này (đo độ đàn hồi) xác định mức độ cứng của gan và lập tương quan với mức độ xơ hóa. Trong tương lai đánh giá độ xơ hóa gan sẽ trở nên quan trọng hơn, còn vai trò của sinh thiết gan có lẽ sẽ giảm đi. Sinh thiết đặc biệt cần làm ở những bệnh nhân người lành mang virus (HBsAg dương tính nhưng không có biểu hiện virus nhân bản). Có nhiều hệ thống phân loại mô học đang được sử dụng. Ở châu Âu, bảng điểm METAVIR được dùng nhiều nhất.
Bảng điểm này phân chia 5 giai đoạn của xơ gan (0=không xơ, 1= xơ khoảng cửa chưa vách hóa, 2= một số vách, 3= nhiều vách nhưng chưa xơ nặng, 4= xơ nặng). Hoạt động viêm ở gan được phân giai đoạn theo mức độ nặng của các tổn thương viêm hoại tử (A0= không phản ứng viêm, A1= phản ứng nhẹ, A2= phản ứng trung bình, A3= phản ứng mạnh). Khuyến cáo điều trị sau đây có thể áp dụng được, nhưng cần khẳng định bằng các nghiên cứu sâu hơn (hình 1 và 2). Cần lưu ý yếu tố HIV, theo đó, 3TC, FTC, tenofovir và entecavir (xem dưới) do cũng có tác dụng với cả HIV nên cần được kết hợp với các thuốc điều trị HIV khác để đảm bảo phác đồ HAART (trị liệu kháng retrovirus hiệu lực cao) đầy đủ. Ngoài ra, adefovir và telbivudin do không tác dụng với HIV nên không được coi là một thành phần của HAART.
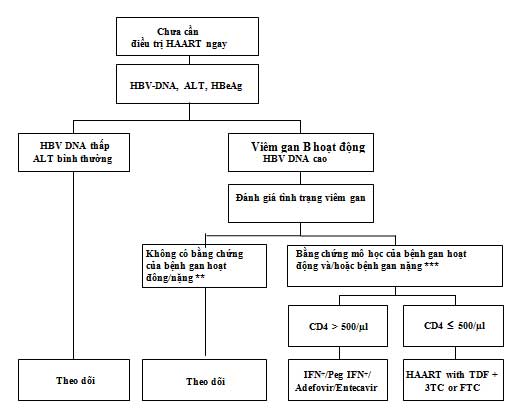
Hình 1: Điều trị bệnh nhân đồng nhiễm HIV/HBV khi chưa có chỉ định HAART (trị liệu kháng retrovirus hiệu lực cao) (theo Alberti 2005)
* HBV-DNA > 20,000 IU/ml ở bệnh nhân HBeAg(+); > 2,000 IU/ml ở bệnh nhân HBeAg(-)
** Metavir < A2 và/hoặc < F2; ***Metavir ≥ A2 và/hoặc F2 (xem phần diễn giải ở trên)
+ IFN và Peg-IFN được ưa chuộng ở bệnh nhân HBeAg dương tính
Theo dõi bao gồm: transaminases mỗi 3 tháng, INR/HBV-DNA mỗi 6 tháng
Điểm cần chú ý chính ở đây là HAART:
- Nếu không cần điều trị HAART, dùng các thuốc không có tác dụng với HIV là lựa chọn tốt nhất (ví dụ adefovir, telbivudin hoặc IFN-α; xem hình 1). Cần tránh lamivudine, emtricitabine, và Điều ngạc nhiên là gần đây người ta đã chứng minh entecavir cũng có tác dụng một phần với HIV. Việc này thậm chí còn dẫn tới chọn lọc đột biến M184V (McMahon 2007). Do đó cần tránh entecavir ở bệnh nhân HIV không có chỉ định điều trị HAART.
- Nếu bệnh nhân đang điều trị HAART (trị liệu kháng retrovirus hiệu lực cao) hoặc cần điều trị HAART (trị liệu kháng retrovirus hiệu lực cao) do CD4 thấp, cần dùng các thuốc có tác dụng với cả HBV và HIV trong phác đồ HAART (trị liệu kháng retrovirus hiệu lực cao) (xem hình 2). Ở bệnh nhân chưa bao giờ điều trị HAART, phối hợp FTC (hoặc 3TC) và tenofovir là hợp lý.
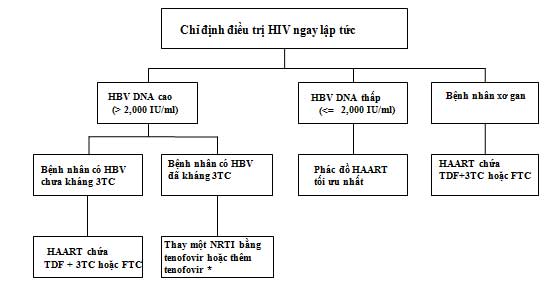
Hình 2: Khuyến cáo điều trị bệnh nhân đồng nhiễm HIV/HBV có chỉ định HAART (trị liệu kháng retrovirus hiệu lực cao) (theo Alberti 2005)
* Nếu tương thích với điều trị HIV. Theo một cách khác, có thể thêm một thuốc không có tác dụng với HIV (tốt nhất là entecavir)
Tăng men gan thoáng qua – thường mức độ vừa và khỏi nhanh – có thể thấy sau khi bắt đầu điều trị HBV. Hiện tượng này do phục hồi miễn dịch gây tăng phản ứng viêm. Trong trường hợp tăng transaminase cao và/hoặc kéo dài, cần tìm các giải thích khác (ví dụ HBV tăng nhân bản, HBV kháng thuốc, toan lactic, độc tính gan do ARV, bội nhiễm một virus viêm gan khác không phải viêm gan B).
ALT trở về bình thường và giảm đáng kể HBV DNA là kết quả thường gặp ở đa số các ca điều trị thuốc kháng HBV. Nồng độ ALT không tương xứng với phản ứng viêm ở gan và chịu ảnh hưởng của rất nhiều yếu tố khác như độc tính gan của HAART (trị liệu kháng retrovirus hiệu lực cao) và các thuốc khác, uống rượu và phục hồi miễn dịch. Do đó, giá trị của ALT trong theo dõi điều trị là hạn chế. Chuyển đảo huyết thanh HBeAg đạt được ở 25% bệnh nhân. Mất HBsAg chỉ đạt được ở 5- 10% bệnh nhân sau 1 năm điều trị IFN-α nhưng ít hơn ở bệnh nhân điều trị nucleoside/nucleotide.Do phần lớn các ca viêm gan B cấp kể cả ở bệnh nhân nhiễm HIV đều tự khỏi, chỉ cần điều trị hỗ trợ. Ngoài ra, dữ liệu về tình trạng này còn hiếm (ví dụ sự nguy hiểm của kháng thuốc trong trường hợp điều trị sớm mà không còn lựa chọn nào sau đó).
