Chẩn đoán huyết thanh Giang mai có nhiều phương pháp khác nhau: Từ những kỹ thuật đơn giản, có tính chất sàng lọc, không đặc hiệu với kháng nguyên là cardiolipin như phản ứng cố định bổ thể BW (Bordet-Wassemann), kỹ thuật VDRL (Venereal Disease Research Laboratory test) của Kolmer, kỹ thuật USR (Unheated Serum Reagin test), kỹ thuật RPR (Rapid Plasma Reagin Card test) đến những kỹ thuật phức tạp, đặc hiệu và có tính chất khẳng định, với việc sử dụng các kháng nguyên chính là xoắn khuẩn Giang mai Treponema pallidum như kỹ thuật bât động xoắn khuẩn Giang mai TPI (Treponema pallidum Immobilization test) của Nelson-Mayer, kỹ thuật kháng thể xoắn khuẩn huỳnh quang FTA (Fluorescent Treponemal Antibody test), kỹ thuật ngưng kết hồng cầu thụ động TPHA (Treponema pallidum Hemagglutination test).
Việc áp dụng các kỹ thuật khác nhau là tùy thuộc vào qui mô, tính chất của công việc đặc biệt là phụ thuộc vào trang thiết bị ở phòng xét nghiệm như máy móc, kính hiển vi. Thiết bị, nhân viên thành thạo kỹ thuật, giá cả cho mỗi lần thử nghiệm.
Để phục vụ cho việc tầm soát Giang mai ở các tuyến cơ sở, chúng tôi giới thiệu hai kỹ thuật tương đối đơn giản là RPR và VDRL.
KỸ THUẬT RPR (Rapid Plasma Reagin Card test)
Nguyên tắc kỹ thuật
Kỹ thuật RPR Card test là những kỹ thuật kết cụm, dùng kháng nguyên cardiolipin được gắn thêm carbone để phát hiện kháng thể reagin Giang mai (hợp chất tương tự kháng thể không đặc ứng, được cấu tạo bởi sự nhiễm khuẩn Treponema pallidum). Kết quả của phản ứng được đọc bằng mắt thường, không cần dùng kính hiển vi. Kỹ thuật được tiến hành tương đối đơn giản, không cần phải sử dụng máy hấp 56°c để khử bổ thể như các kỹ thuật thông dụng khác (vì trong thuốc thử – kháng nguyên – của kỹ thuật RPR đã có hóa chất sẵn để làm mất hoạt tính của bổ thể). Thuốc thử và các dụng cụ cần thiết để làm phản ứng đều được chuẩn bị sẵn sàng trong từng bộ (kít), thời gian để tiến hành phản ứng nhanh, độ nhạy cảm cao (vì ở trong huyết tương có nồng độ kháng thể reagin cao hơn trong huyết thanh) đó là những ưu điểm đặc biệt của kỹ thuật RPR, đó cũng là lý do để phổ biến kỹ thuật này một cách rộng rãi đến tận những cơ sở không có phòng thí nghiệm trong việc tầm soát bệnh Giang mai.
Kỹ thuật RPR có hai phương pháp khác nhau:
Phương pháp sử dụng tấm giấy cứng có các giếng trũng hình tròn với đường kính 14mm, 18mm được dùng máy để lắc (như kỹ thuật RPR Macrovue R: sử dụng ống phân phối mỗi mẫu thử bằng nhựa một đầu để nhỏ giọt, một đầu dùng để dàn đều mẫu thử trên giếng: Card Test Using Dispenstirs của Becton Dickinson Microbiology Systems-USA (Kit No. 110-500 test) hay kỹ thuật RPR-Nosticon II, sử dụng ống mao quản bằng nhựa với quả bóp cao su dùng để phân phối mẫu thử và que nhựa để dàn đều mẫu thử: Card Test Using Capillaries của hãng Organon Teknika.
Phương pháp sử dụng tấm giây cứng có chứa các giếng trũng hình giọt lệ thì lắc bằng tay, không phải dùng máy lắc: RPR “Teardrop” Card test-Hand Rotation. Trong phương pháp giọt lệ lắc tay này có hai nhóm kit khác nhau:
+ Một loại kit có chứa dụng cụ lấy máu đầu ngón tay (Blood Lancet) và các tấm bìa có giếng trũng hình chìa khóa chứa chất kháng đông dùng để kháng máu và tách huyết tương (Brewer plasma collection slide) ngoài các mao quản và que tăm.
+ Một loại kit có chứa các mao quản thủy tinh và các các quả bóp cùng với các que tăm dùng lấy mẫu và trộn mẫu, không có các tấm bìa có giếng hình khóa, mẫu thử được lấy máu ở tĩnh mạch và được chứa ở tube đã có sẩn chất kháng đông (một kit đủ dùng cho 100 test).
Tiến hành kỹ thuật: (Giới thiệu hai kỹ thuật của hai phương pháp: lắc tay và lắc máy)
Phương pháp lắc tay – RPR “Teardrop” (Giếng hình giọt lệ – lấy, chứa và tách huyết tương trên tấm bìa)
- Chuẩn bị dung cu và thuốc thử: Dụng cụ và thuốc thử được đựng trong một hộp (hãng sản xuất: Hynson. Westcott & Dunning).
Kit 102: đủ để dùng cho 100 test gồm có:
Hai chai đựng kháng nguyên có ghi hạn dùng (mỗi chai lml). Thành phần của huyền trọc kháng nguyên gồm 0,003% cardiolipin, 0,020-0,022% lecithin, 0,09% cholesterol, 0,0125M EDTaT 0,01M Na2HP04, 0,01M KH2HPƠ4, 0,1% certhiolate, 0,01875% than (charcoal), 10% choline chloride và nước cất.
Kim 21G màu xanh lá cây, đầu bằng (1 giọt tương đương vớil/70ml).
Chai không, bằng nhựa dùng để phân phối kháng nguyên sau khi đã được gắn với kim 21G.
Một hộp giấy chứa 200 que gỗ dùng để trộn kháng nguyên với mẫu thử.
10 tấm giây cứng màu xanh lá, mỗi tấm chứa 10 giếng trũng hình giọt lệ.
100 thẻ có giếng trũng hình khóa được tráng chất kháng đông dùng để chứa và tách huyết tương của mẫu thử.
100 ống mao quản thủy tinh có vạch 0,03ml dùng để hút huyết tương vào tấm bìa thử.
03 quả bóp cao su và 100 dao nhọn mũi (lancet).
Chủ ỷ: Huyền trọc kháng nguyên cần được bảo quản ở nhiệt độ lạnh 4-8°C, không được để ở ngăn đá.
- Thực hiện kỹ thuât
Kiểm tra độ nhạy của huyền trọc kháng nguyên bằng cách thử nghiệm với những kiểm chứng có hiệu giá đã được biết trước và chỉ những huyền trọc nào cho phản ứng được qui định mới được dùng làm thử nghiệm. Mẩu kiểm chứng và huyền trọc kháng nguyên, mẫu thử được đặt ở nhiệt độ phòng khi thử nghiệm (22-29°C).
Lắc ống kháng nguyên để trộn đều huyền trọc (khoảng 10-15 giây), cưa bẻ ống kháng nguyên rồi hút tất cả huyền trọc vào chai nhựa.
Lắc nhẹ chai phân phối chứa huyền trọc kháng nguyên mỗi khi nhỏ giọt.
Lấy huyết tương:
+ Thẻ lấy huyết tương có một vùng trũng hình khóa, đường kính vòng lớn khoảng 2,5cm. Phần đầu của thẻ có một đường đục lỗ nhỏ sấn có thể bẻ gập xuống thành chỗ tựa để cho huyêt tương chảy xuống phần trũng hẹp của hình khóa (vùng trũng của giếng hình khóa có tráng chất kháng đông và lecitin bền ở nhiệt độ thường. Lecitin có tác dụng gây ngưng tập hồng cầu, bạch cầu vì vậy chỉ để cho một mình huyết tương chảy xuông, hồng cầu, bạch cầu được giữ lại ở phần trũng lớn).
+ Ghi tên bệnh nhân hay mã số vào thẻ ở phần cuối của hình chìa khóa.
+ Dùng alcool sát khuẩn chỗ định lấy máu (đầu ngón tay, ngón chân, dái tai). Chích lấy máu bằng dao nhọn mũi (lancet) vô khuẩn.
+ Để cho 3 giọt máu chảy vào chỗ trũng tròn trên thẻ, cẩn thận không cho máu chảy vào phần rãnh gom huyết tương.
+ Cầm que tăm có sẩn để nằm hơi ngang, nhẹ nhàng dàn đều khắp vòng tròn lớn trong khoảng 20-30 giây, cẩn thận tránh để máu đụng vào vành mực của phần trũng tròn.
+ Cầm thẻ trộn đều máu với chất kháng đông bằng cách vừa xoay vừa nghiêng máu chảy quanh theo phần trũng tròn cho đến khi các huyết cầu ngưng tập thành cụm rõ ràng, đồng thời huyết tương được tách rời.
+ Đặt thẻ lên bàn, đường có khoan lỗ thẳng với cạnh của bàn, phần ngắn của thẻ ở phía ngoài, bẻ gặp phần này theo cạnh bàn.
+ Đặt thẻ lên mặt phẳng để huyết tương nghiêng chảy xuống rãnh gom, thường mất khoảng 2 phút.
Lấy huyết thanh: Huyết thanh không hấp, trích lấy từ mẫu máu chứa trong ống nghiệm
khô, sạch, có thể được dùng để thay thế huyết tương trong thử nghiệm này.
Làm thử nghiệm:
+ Gắn ống mao quản vào quả bóp cao su: Hút 0,03ml huyết tương (hoặc huyết thanh, mực mẫu thử lên tới vạch đen của ống mao quản) tránh không được để huyết tương hoặc huyết thanh lên tới quả bóp cao su vì như vậy sẽ làm sai lệch kết quả của những lần thử nghiệm kế tiếp.
+ Cho 0,03ml huyết tương hay huyết thanh vào “giọt lệ ” của tấm giấy cứng thử nghiệm.
+ Dùng chai phân phối huyền trọc kháng nguyên nhỏ 1 giọt (= l/70ml) vào giếng giọt lệ đã có 0,03ml mẫu thử (chú ý: lắc nhẹ chai đựng kháng nguyên trước khi nhỏ, khi nhỏ giọt phải cầm chai thẳng đứng).
+ Dùng đầu lớn của que tăm gỗ trộn đều và dàn trải hỗn hợp kháng nguyên + mẫu thử lên khắp bề mặt của giếng giọt lệ (chú ý: mỗi giếng phải dùng một que tăm riêng).
+ Lắc tay: Động tác này rất quan trọng: lắc nghiêng lên xuống tấm card một cách hơi chậm (khoảng 20 lần/ phút). Thời gian lắc là 4 phút để cho hỗn hợp luân chuyển đến đỉnh rồi phân tán khi chảy rời khỏi đỉnh giọt lệ. Khi có sự ngưng tập xuất hiện trước 4 phút thì không cần thiết phải lắc nữa. Tuy nhiên thời gian 4 phút cần phải theo đúng để kết luận đối với những mẫu thử âm tính.
+ Đọc kết quả ngay sau khi đã lắc 4 phút và ghi kết quả như sau:
. Dương tính (reactive): Có sự kết cụm vừa hoặc lớn.
. Dương tính yếu (moderately reactive): Sự kết cụm nhỏ.
. Âm tính (non-reactive): Không có sự kết cụm.
Phương pháp lắc máy – RPR Giếng tròn
- Chuẩn bị dụng cụ và thuốc thử: Dụng cụ và thuốc thử được đựng trong một hộp (thường một hộp chứa 500 test, hãng sản xuất Organon…) gồm có:
5 chai nhỏ chứa huyền trọc kháng nguyên (2ml/chai), có chất bảo quản 0,1% sodium azide.
2 chai chứa chứng dương (lml/chai): Kháng thể kháng Treponema pallidum ở huyết thanh người; chất bảo quản; 0,15 sodium azide.
2 chai chứng âm (lml/chai): Huyết thanh người, có 0,1% sodium azide.
50 tấm card test, mỗi tấm chứa 10 giếng tròn (có d = 18mm).
500 ống hút bằng nhựa.
2 quả hút để dùng cho ống hút.
500 que quậy mẫu bằng nhựa.
2 chai phân phối bằng nhựa.
2 kim phân phối.
- Báo quản thuốc thử
Nếu được bảo quản ở 2-8°C thì kit sẽ được ổn định cho đến ngày hết hạn dùng được ghi ngoài hộp. Tất cả thuốc thử phải được làm ấm bằng cách để ở nhiệt độ phòng trước khi thử nghiệm, nếu không kết quả âm tính giả có thể xảy ra. Không được làm đông huyền trọc kháng nguyên. Không cất giữ huyền trọc kháng nguyên ở chai phân phối bằng nhựa vì nó sẽ làm giảm hạn dùng của sản phẩm. Sau khi mở hộp, để các tấm giấy card test ở nhiệt độ phòng, không đặt ở tủ lạnh.
- Mẫu thử
Huyết tương hoặc huyết thanh đều có thể được dùng. Tất cả mẫu thử phải không được tán huyêt hay nhiễm khuẩn. Mẩu thử nào không thử nghiệm ngay thì nên bảo quản chúng ở nhiệt độ 2-8°C. Nếu để mẫu thử quá 24 giờ thì nên được đòi hỏi bảo quản mẫu thử ở -20°c.
- Chuẩn bi thuốc thử
Huyền trọc kháng nguyên sẩn sàng sử dụng, cho phép lấy huyền trọc kháng nguyên ra để ở nhiệt độ phòng và lắc kỹ trước khi sử dụng.
Khi sử dụng: Mở nắp của chai phân phối và nôi với một kim phân phối, vặn chặt lại. Sau đó chuyển huyền trọc kháng nguyên vào chai nhựa phân phôi bằng cách bóp chai nhựa phân phối đê hút kháng nguyên từ chai đựng kháng nguyên có sẩn. Sau mỗi ngày thử nghiệm, số kháng nguyên dư thừa phải được đổ lại chai thủy tinh ban đầu dùng để chứa kháng nguyên.
Rửa sạch chai đựng và kim phân phối rồi để khô. Chứng dương và chứng âm có sẩn để sẩn sàng sử dụng.
- Các bước tiến hành thử nghiêm
Gắn quả bóp có sẩn vào ống hút bằng nhựa, hút đủ mẫu rồi nhỏ 1 giọt mẫu thử (để rơi tự do) vào giếng vòng tròn trên tấm card. Mỗi mẫu thử phải dùng một ống hút riêng. Để thật chính xác khi phân phối giọt mẫu thử thì điều quan trọng là phải giữ ống hút ở tư thế thẳng đứng khi nhỏ giọt.
Dùng một que nhựa trải rộng, dàn đều mẫu thử lên khắp toàn bộ mặt phẳng của vòng ưòn giếng.
Làm cho huyền trọc kháng nguyên được đồng nhất bằng cách lắc nhẹ chai nhựa phân phối có chứa kháng nguyên (+ kim phân phối), giữ chai theo phương thẳng đứng và nhỏ một giọt để rơi tự do vào giếng tròn đã có mẫu thử được dàn trải trước đó (không được quậy trộn kháng nguyên với mẫu thử).
Đặt ngay tấm card vào máy lắc tự động và lắc trong 8 phút ở tốc độ 100 vòng/phút (nếu không có máy, chúng ta có thể cải tiến bằng cách lắc vòng tròn với thời gian và tốc độ tương đương).
- Đoc kết quả: Đọc kết quả ngay khi lắc xong. Đọc bằng mắt thường ở ánh sáng ban ngày tốt.
Âm tính (negative): Xuất hiện một sự tập trung các hạt carbon ở trung tâm vòng tròn một cách mềm mại, mịn màng hoặc huyền trọc màu xám trải đều khắp giếng tròn.
Dương tính yếu (weakly positive): Phản ứng được biểu thị bằng sự tập trung các hạt đen mịn khuếch tán ở một khu vực.
Dương tính (positive): Phản ứng được biểu hiện bằng sự tập hợp các hạt đen hầu hết phổ biến đều khắp bề mặt của giếng tròn.
KỸ THUẬT VDRL (Venereal Disease Research Laboratory test)
Nguyên tắc kỹ thuật
Kỹ thuật VDRL là kỹ thuật phản ứng lên bông (kỹ thuật kết cụm, kháng nguyên được dùng trong phản ứng là cardiolipin (được chiết xuất từ tim bò) để phát hiện kháng thể kháng lipid (còn gọi là reagin). Kết quả được nhận định ở kính hiển vi quang học, quá trình thực hiện phản ứng phải sử dụng máy hấp 56°c, máy lắc…
Chuẩn bị thực hiện kỹ thuật
Chuẩn bị dụng cụ
Máy hấp ướt (incubator) 56°c.
Máy lắc tròn (rotator) điều chỉnh tốc độ 180 vòng/phút.
Kim tiêm đầu bằng 18G, 19G, 23G.
Pipette 0,05ml hoặc micropipette 50pl.
Bút lông.
Plate thủy tinh 12 giếng (đường kính nền giếng 14mm).
Chai thủy tinh 30ml có nút thủy tinh, đáy chai phẳng.
Ống chích l-2ml.
Chuẩn bị thuốc thử
VDRL antigen.
VDRL buffered saline.
Huyết thanh cần thử nghiệm.
Pha kháng nguyên để thử nghiệm
Nhiệt độ thích hợp ở phòng pha kháng nguyên là 23°C-29°C.
Hút 0,4ml buffered saline cho tận đáy chai thủy tinh.
Hút 0,5ml antigen nhỏ trực tiếp vào chai từng giọt nhanh (tốc độ khoảng 6 giây, nhỏ hêt 0,5ml), vừa nhỏ antigen vừa quay lắc chai bằng tay, sau đó tiếp tục lắc chai thêm 10 giây nữa (khi đã nhỏ hết antigen).
Cho tiếp 4,1ml buffered saline, đậy nút chai và lắc mạnh lên xuống 30 lần trong 10 giây.
Lượng antigen này đủ dùng cho 20 mẫu thử (định tính) và chỉ dùng được trong vòng 24 giờ, nếu muốn dùng để tồn trữ được lâu hơn chúng ta phải phá thành kháng nguyên ổn định.
Thử độ phân phối chính xác của kim
Kim 18G (đầu bằng) kiểm tra lại có độ lượng 60 giọt/ml.
Kim 19G (đầu bằng) chỉnh để có độ lượng 75 giọưml.
Kim 23G (đầu bằng hoặc nhọn) chỉnh để có độ lượng 100 giọưml.
Thử độ nhạy của antigen
Thử với huyết thanh chứng theo phương pháp VDRL, định lượng cả với chứng âm và chứng dương. Các phản ứng huyết thanh kiểm chứng phải cho lại các độ phản ứng đã khẳng định lần trước (âm tính cũng như dương tính). Nếu kết quả thử có sự khác biệt so với lần trước thì không dùng antigen này nữa.
Chuẩn bị huyết thanh
Huyết thanh được tách bằng máy ly tâm hoặc để tự lắng. Sau đó được khử bổ thể ở nhiệt độ 56°c, huyết thanh chưa được thử nghiệm để quá 4 giờ thì phải hấp lại 56°c trong 10 phút nữa.
Lấy huyết thanh ra để ở nhiệt độ phòng trước khi thử nghiệm.
Tiến hành kỹ thuật
Định tính
Hút 0,05ml huyết thanh cho vào giếng làm phản ứng của tấm Plate thủy tinh. Sau đó cho tiêp 1 giọt (l/60ml) antigen (kim 18G), trộn đều và lắc tròn ở máy lắc 180 vòng/phút. Lắc trong 4 phút, lấy ra đọc kết quả bằng kính hiển vi với thị kính 10X, vật kính 10X.
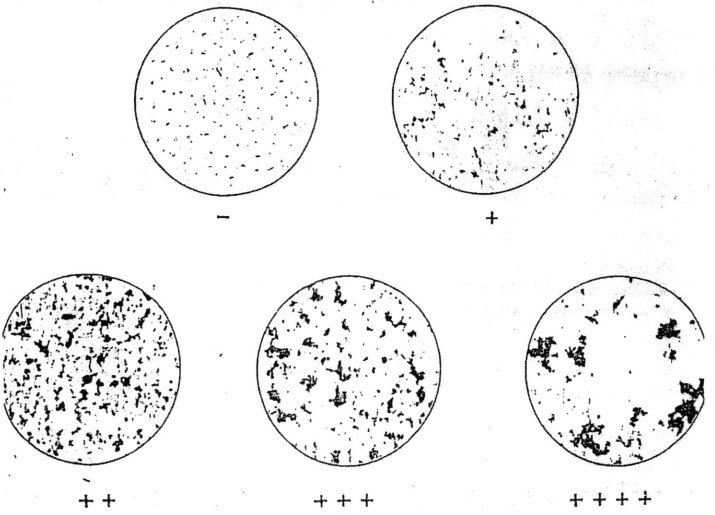
- Đánh giá kết quả
Dương tính (R): Kết cụm vừa hoặc lớn.
Dương tính yếu (WR): Kết cụm nhỏ, rất nhỏ.
Âm tính (N): Không kết cụm.
Chú ý: Trong những trường hợp dương tính yếu hoặc âm tính “không đẹp”: Các hạt kháng nguyên lớn, hột không đều thì nên làm lại bằng phương pháp định lượng vì có thể đó là “hiện tượng vùng” (hiện tượng kháng thể quá nhiều trong mẫu thử).
Định lượng: Huyết thanh được pha loãng 1/2, 1/4, 1/8, 1/16, 1/32…
- Cách pha:
Sử dụng: – Micropipette 50μl (để phân phối huyết thanh).
Kim đầu bằng 18G (để phân phối kháng nguyên).
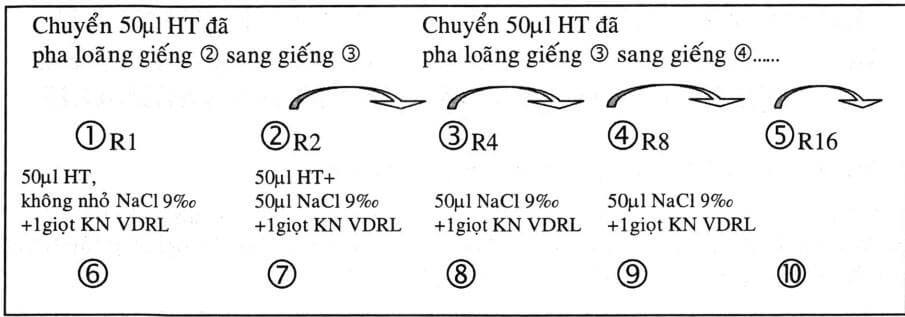
Bước 1: Nhỏ 0,05ml (≈ 50μl) huyết thanh vào giếng ① và giếng ②
Bước 2: Nhỏ 0,05ml (≈ 50μl) NaCl 9%0 vào giếng ②, ③, ④…
Bước 3: Trộn đều huyết thanh và NaCl 9%0 ở giếng ②, chuyển 0,05ml (≈ 50ml) huyết thanh đã pha loãng ở giếng ② sang giếng ③, tiếp tục trộn đều ở giếng ③, chuyển 0,05ml (≈ 50μl) huyết thanh pha loãng ở giếng ③ sang giếng ©…
Bước 4: Nhỏ vào tất cả các giếng từ giếng số ① , ②, ③… mỗi giếng l/60ml kháng nguyên VDRL (≈ 1 giọt của kim đầu bằng 18G). Sau đó lắc ở máy lắc tròn, tốc độ 180 vòng/phút, trong 4 phút. Đọc kết quả ở kính hiển vi quang học, vật kính 10X, thị kính 10X.
Nhận định kết quả
Dương tính ở giếng cuối cùng —> Hiệu giá kháng thể được xác định ở giếng đó.
Ví dụ: Rl, R2, R4, R8…
ĐỌC KẾT QUẢ – KỸ THUẬT VDRL