Từ khi HIV-1 được mô tả lần đầu năm 1983 (Barre-Sonoussi 1983, Gallo 1983) và HIV-2 năm 1986 (Clavel 1986), hai virus này đã được xác định là nguyên nhân gây ra hội chứng suy giảm miễn dịch mắc phải (AIDS) trong 20 năm qua. Do HIV-1 là căn nguyên chính gây AIDS, chúng ta sẽ chỉ thảo luận tập trung vào virus này. Trên thế giới hiện nay, số người nhiễm HIV-1 đã vượt quá con số 40 triệu, và phần lớn trong số đó sống ở các nước đang phát triển ở châu Phi hạ Sahara, châu Á và Nam Mỹ.
Sự ra đời của các thuốc ức chế men protease và thuốc ức chế men sao chép ngược không phải nucleotide (NNRTI) năm 1995 đã bắt đầu kỷ nguyên trị liệu kháng retrovirus hiệu lực cao (HAART) và tạo ra những tiến bộ vượt bậc về tỷ lệ mắc và tử vong của HIV với sự giảm rõ rệt các nhiễm trùng cơ hội, khối u và tử vong. Mặc dù đã đạt được những thành tựu về điều trị như vậy, khi một bệnh nhân đã nhiễm virus, việc loại bỏ hoàn toàn virus là không thể.
Ngoài ra, cũng đã nảy sinh các vấn đề về độc tính sớm và độc tính lâu dài của thuốc, vấn đề đột biến kháng thuốc ở các virus lưu hành cũng như virus lây truyền. Ở phần lớn các nước Đông Nam Á và châu Phi, tỷ lệ mới mắc và hiện mắc HIV-1 vẫn tiếp tục tăng và vượt qua các con số thống kê ở châu Âu và Bắc Mỹ. Tuy nhiên do giá thuốc đắt và cơ sở hạ tầng y tế thiếu thốn ở các nước đang phát triển, việc sử dụng rộng rãi HAART vẫn còn khó khăn. Tiến triển của đại dịch HIV-1 do đó sẽ phụ thuộc vào việc liệu các nước đang phát triển có tỷ lệ mắc cao có tiếp cận được các tiến bộ về y học như ở châu Âu và Bắc Mỹ hay không, và liệu vacxin phòng bệnh có được tạo ra trong tương lai gần hay không.
Hiểu quá trình bệnh sinh và miễn dịch của nhiễm HIV-1 là một điều kiện tiên quyết để phát triển các chiến lược điều trị, các biện pháp miễn dịch trị liệu và vacxin. Giống như các virus khác, diễn biến của nhiễm HIV-1 phụ thuộc vào cả yếu tố vật chủ lẫn yếu tố virus.
Diễn biến của nhiễm HIV-1 ở người rất khác nhau, thậm chí khi nhiễm virus từ cùng một nguồn (Liu 1997). Ở một số người có hiện tượng nhiễm HIV-1 không tiến triển (tức là không thấy CD4 giảm, hoặc nhiễm virus trong ít nhất 7 năm mà không xuất hiện AIDS) và các hạt virus có khiếm khuyết đã được tìm thấy ở những người này (Kirchhoff 1995). Vì vậy, nhiễm một virus có khiếm khuyết, hoặc virus có khả năng nhân bản kém có thể kéo dài diễn biến của bệnh. Tuy nhiên, ở đa số người nhiễm, đặc điểm của virus là khả năng nhân bản cao với tốc độ quay vòng hàng ngày rất lớn của các hạt virus.
Các yếu tố vật chủ cũng góp phần quyết định liệu một người nhiễm HIV-1 sẽ tiến triển rất nhanh đến suy giảm miễn dịch nặng hay duy trì tình trạng không tiến triển (nhóm này chiếm 5% tổng số người nhiễm). Việc xác định và tìm hiểu đặc điểm các yếu tố vật chủ tham gia quyết định diễn biến của nhiễm HIV (bao gồm cơ chế miễn dịch bảo vệ và các yếu tố di truyền) sẽ rất quan trọng để chúng ta hiểu được bệnh sinh của HIV và để phát triển các chiến lược điều trị và dự phòng.
Cấu trúc của HIV-1
HIV-1 là một retrovirus thuộc họ lentivirus. Nhiễm các lentivirus thường có diễn biến mạn tính, có thời kỳ tiềm tàng kéo dài, virus nhân bản liên tục và tổn thương thần kinh trung ương. Nhiễm visna ở cừu, virus gây suy giảm miễn dịch ở khỉ (SIV) hay virus gây suy giảm miễn dịch ở mèo (FIV) đều là các ví dụ điển hình của lentivirus.
Trên kính hiển vi điện tử, HIV-1 và HIV-2 có cấu trúc gần như giống nhau hoàn toàn. Chúng chỉ khác nhau ở trọng lượng của các protein cũng như các gen phụ trợ. HIV-2 gần hơn về mặt di truyền với SIV ở các con khỉ sootey mangabeys (SIVsm) và rất có khả năng HIV-2 được truyền sang người từ khỉ. Cả HIV-1 và HIV-2 đều nhân bản trong tế bào CD4 và đều gây bệnh ở người, mặc dù mức độ suy giảm miễn dịch do HIV-2 gây ra là ít hơn.
Cấu trúc hình thể của HIV-1
Hạt virus HIV-1 có đường kính 100 nm và được bao quanh bởi màng lipoprotein. Mỗi hạt virus chứa 72 phức hợp glycoprotein được gắn vào màng lipid này, và mỗi phức hợp là một trimer gồm một glycoprotein ngoại bào gp120 và một protein xuyên màng gp41. Liên kết giữa gp120 và gp41 lỏng lẻo và do đó gp120 có thể được phân tán tự do ra xung quanh.
Glycoprotein gp120 có thể được phát hiện trong huyết thanh cũng như mô bạch huyết của bệnh nhân HIV. Trong quá trình nảy chồi, virus có thể gắn thêm các protein của vật chủ từ màng của tế bào vật chủ vào lớp lipoprotein của virus, ví dụ các protein HLA lớp I và II, hoặc các protein kết dính như ICAM-1 giúp virus gắn vào tế bào đích. Protein p17 được gắn vào mặt trong của màng lipoprotein. Kháng nguyên lõi p24 chứa 2 bản sao của HIV-1 RNA.
HIV-1 RNA là một phần của phức hợp protein-nucleic acid, gồm nucleoprotein p7 và men sao chép ngược p66 (RT). Như vậy một hạt virus chứa mọi thành phần men cần thiết cho nhân bản: men sao chép ngược (RT), integrase p32 và một protease p11 (tổng quan trong: Gelderblom 1993) (Hình 1).
Tổ chức bộ gen của virus
Mọi retrovirus có khả năng nhân bản đều dựa vào 3 gen: gag, pol và env: gag có nghĩa “group-antigen” (kháng nguyên nhóm), pol là “polymerase” và env là “envelope” (vỏ) (tổng quan ở: Wong-Staal 1991) (Hình. 2). Cấu trúc “cổ điển” của bộ gen retrovirus là: 5’LTR-gag- pol-env-LTR 3’. Vùng LTR (“long terminal repeat” hay “đoạn lặp tận”) là hai đầu của bộ
gen virus, nối với DNA tế bào vật chủ sau khi tích hợp và không mã hóa cho bất cứ protein nào của virus. Các gen gag và env mã hóa cho nucleocapsid và glycoprotein của màng virus; gen pol mã hóa cho men sao chép ngược và các men khác. Ngoài ra, HIV-1 còn có 6 gen (vif, vpu, vpr, tat, rev và nef) ở vùng RNA 9kB. Nef, vif, vpr và vpu trong quá khứ được coi là các gen phụ do virus không cần các gen này để nhân bản in vitro. Các gen phụ nef, tat và rev đều được tạo ra sớm trong chu kỳ nhân bản của virus.
Tat và rev là các protein điều hòa được tích lũy trong nhân và gắn vào các vùng định sẵn của RNA virus, tương ứng là TAR (transactivation-response elements hay phân tử đáp ứng hoạt hóa) trên LTR và RRE (rev response elements hay phân tử đáp ứng rev) trên gen env. Protein tat là một chất kích hoạt quá trình nhân bản rất mạnh của vùng hoạt hóa LTR (LTR promoter region) và rất cần cho quá trình nhân bản của virus trong mọi hệ thống nuôi cấy in vitro.
Cyclin T1 là một đồng yếu tố cần thiết của tat (Wei 1998). Tat và rev kích thích sự chuyển HIV-1 DNA tiền virus (proviral) thành RNA, kích thích sự kéo dài của RNA, tăng cường vận chuyển HIV RNA từ nhân ra bào tương và rất cần thiết cho quá trình dịch mã. Rev cũng là yếu tố quan trọng của nhân giúp chuyển sự bộc lộ sớm các protein điều hòa thành các protein cấu trúc được tổng hợp muộn hơn.
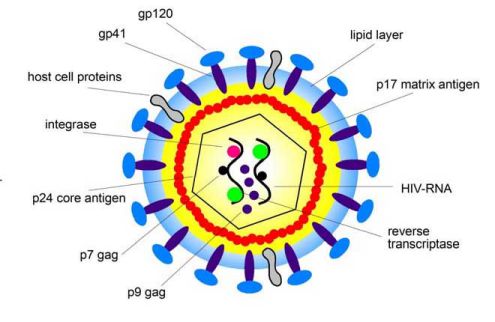
Hình 1: Cấu trúc của một hạt virus HIV. Xem phần lời ở trên.
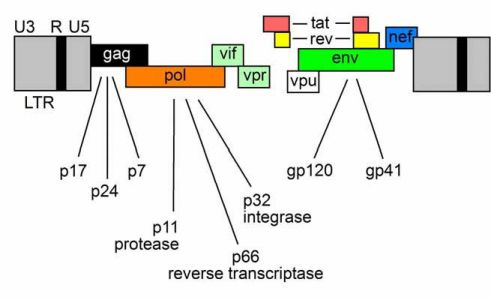
Hình 2: HIV và các gen của nó. Xem phần lời ở trên.
Nef có một số chức năng. Nef có thể gây điều hòa ngược (downregulation) CD4 (Aiken 1994) và HLA lớp I (Collins 1998) trên bề mặt của tế bào nhiễm HIV-1, và đây có lẽ là một cơ chế giúp virus trốn tránh sự tấn công của T CD8 gây độc tế bào và tránh được sự nhận diện của các T CD4. Nef có thể can thiệp vào quá trình hoạt hóa tế bào T bằng cách gắn vào các protein tham gia các con đường truyền tín hiệu nội bào (tổng quan ở: Peter 1998). Ở các con khỉ rhesus macaques nhiễm SIV, gen nef toàn vẹn là rất cần thiết để virus sinh sôi nhanh và bệnh tiến triển. HIV-1 không có nef đã được tìm thấy ở một nhóm các bệnh nhân người Úc không tiến triển bệnh trong thời gian dài (long-term non-progressors). Tuy nhiên, một số báo cáo gần đây cho thấy một vài bệnh nhân trong số đó đã bắt đầu có các dấu hiệu bệnh tiến triển cùng với giảm CD4. Vì thế, cho dù mất gen nef có thể làm chậm sự nhân bản của virus, không phải lúc nào cũng ngăn được sự xuất hiện của AIDS.
Vpr có lẽ cần thiết cho quá trình nhân bản của virus ở các tế bào không phân chia ví dụ đại thực bào. Ngoài các yếu tố kích thích khác của tế bào và virus, vpr cũng có thể kích thích HIV-LTR. Gần đây, người ta thấy vpr có vai trò quan trọng trong vận chuyển phức hợp tiền tích hợp của virus vào nhân (tổng quan ở Miller 1997) và có thể làm ngừng chu kỳ tế bào ở G2.
Vpu có vai trò quan trọng trong quá trình nảy chồi của virus bởi các đột biến của vpu khiến các hạt virus nằm mãi trên màng tế bào vật chủ. Vpu còn liên quan tới sự thoái giáng của phức hợp CD4-gp160 trong lưới nội nguyên sinh và do đó cho phép gp160 được quay vòng để tạo các hạt virus mới (Cullen 1998).
Một số ấn bản gần đây đã nhấn mạnh vai trò của vif trong quá trình nhân bản của virus (Mariani 2003). Các virus HIV-1 không có vif không thể nhân bản trong tế bào CD4, một số dòng tế bào T (“tế bào không chấp nhận”) hay trong đại thực bào. Các chủng virus không có vif có thể xâm nhập tế bào đích và khởi động quá trình sao chép ngược nhưng sự tổng hợp DNA tiền virus diễn ra không hoàn chỉnh. Sự kết dính các tế bào “chấp nhận” và “không chấp nhận” in vitro dẫn tới một kiểu hình “không chấp nhận”, chứng tỏ sự nhân bản của HIV phụ thuộc vào việc có hay không một chất ức chế của tế bào. Yếu tố ức chế này được xác định là APOBEC3G (Sheehy 2002). APOBEC3G (“apolipoprotein B mRNA editing enzyme catalytic polypeptide-like 3G”) thuộc họ các men nội bào có khả năng khử amin đặc hiệu cytosine thành uracil ở mRNA hoặc DNA dẫn tới tích lũy các đột biến G-thành-A, kết quả là thoái giáng DNA của virus. Với khả năng tạo phức hợp với APOBEC3G, vif ngăn hoạt động ức chế của APOBEC3G (Hình 3a)
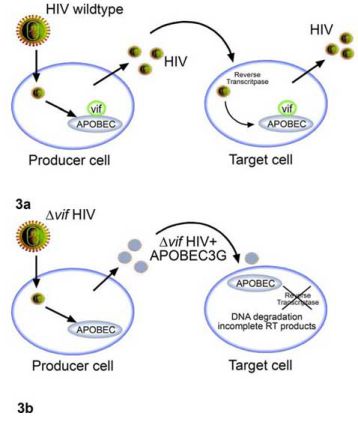
Hình 3: Nhiễm HIV-1 chủng hoang dại: vif tương tác với APOBEC3G, gắn với APOBEC3G và ngăn sự hợp nhất của nó trong virus mới sinh (Hình 3a). Virus HIV không có vif không thể ức chế APOBEC3G nội bào, phân tử này sẽ hợp nhất trong virus mới và ngăn cản sao chép ngược ở tế bào đích (Hình 3b).
Điều thú vị là khả năng kháng virus của APOBEC3G được bảo tồn ở nhiều loài, trong khi việc ức chế APOBEC3G của vif là đặc hiệu cho HIV. Thành phần vif của HIV-1 không kết hợp được với APOBEC3G của chuột hay khỉ. Khi không có vif, APOBEC3G sẽ có trong hạt virus mới tạo thành và ở tế bào đích, quá trình tổng hợp DNA tiền virus bị ngăn lại (Hình 3b). Ngược lại, khi có vif, APOBEC3G bị thoái giáng và không được đưa vào virus mới.
APOBEC3G được bộc lộ ở lympho bào và đại thực bào là các tế bào đích của HIV.
Hiện vẫn còn nhiều câu hỏi ngỏ về sự điều hòa của APOBEC3G nội bào: ví dụ liệu có một lượng đủ lớn APOBEC3G nội bào để ngăn cản nhiễm HIV khi có vif, hay liệu có tồn tại các đa hình di truyền của APOBEC3G ảnh hưởng tới diễn biến của bệnh. Người ta cũng thấy rằng các tế bào có nhánh điều hòa thuận (upregulate) APOBEC3G trong quá trình trưởng thành (Pion 2006). Ngoài ra, chức năng men của APOBEC3G nội bào trong tế bào lympho có thể phụ thuộc vào tình trạng hoạt hóa của tế bào (Chiu 2005). Tuy nhiên, vùng epiptope mà vif và APOBEC3G tương tác với nhau đã được xác định và con đường thoái giáng nội bào của phức hợp APOBEC3G-vif cũng đã được tìm ra. Các chất ức chế đặc hiệu ngăn cản sự tương tác giữa vif và APOBEC3G hoặc can thiệp vào sự thoái giáng nội bào của APOBEC3G có thể là những hướng điều trị mới trong tương lai. Về nguyên tắc, ngăn cản các cấu trúc của tế bào có thể gây một nguy cơ nhỏ rằng sự xuất hiện đề kháng sẽ làm mất hiệu quả của thuốc kháng virus. Vì vậy, các hướng nhằm vào vif và APOBEC3G là các hướng điều trị mới rất thú vị.
